昼消积雪,夜涌狂澜!nash药物研发在2022年似乎迎来了转机。7月,intercept宣布奥贝胆酸关键iii期regenerate研究新中期分析达到了预设的主要终点;9月,akero公布了efruxifermin治疗nash的iib期数据,肝穿刺活体组织学数据惊艳四座;12月,madrigal宣布thr-β激动剂resmetirom治疗nash的iii期maestro研究达到了双重主要终点。公布结果的当日,madrigal股价大涨268%,市值超过了40亿美元。受这一事件的催化,国内外一批nash概念股也迎来普涨……
重赏之下,必有勇夫
非酒精性脂肪肝(nonalcoholic fatty liver disease,nafld)是指酒精和其它明确的损肝因素之外所致的肝细胞内脂肪过度沉积引发的代谢应激性肝脏损伤。2022年9月,《柳叶刀》子刊发表的一项针对全球nafld流行病学系统性回顾和荟萃分析显示,目前全球成人nafld患病率约为32.4%[1]。换句话说,全球平均每3个人中就有1人罹患nafld。
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,nash)是nafld进展而来的严重慢性肝脏疾病,流行病学数据显示,15%~25%的nafld患者最终会发展为nash。nash可能继续发展成进行性纤维化,并且与肝癌的发生风险直接相关[2]。然而,目前针对nash几乎无药可治(只有印度批准了一款pparα激动剂saroglitazar),患者有着巨大的未满足临床需求,迫切需要开发有效的治疗方法来解决这一全球健康问题。
nash药物研发的难点很大程度上源于nash复杂的致病机制——涉及多条通路、多个靶点、多种细胞交叉相互作用,目前并没有找出最具说服力的主要致病机理。2020年2月,国际脂肪肝专家小组曾在gastroenterology发表文章,表示nash这一术语无法准确描述代谢功能障碍在驱动其病理生理学中发挥的作用,建议改为mash(metabolic associated steatohepatitis,代谢相关脂肪性肝炎)[3]。
此外,全球药监部门对nash药物开发的临床终点有着严格的标准。如fda规定nash药物iii期临床试验的替代终点必须采用肝穿刺活组织进行病理学评价,要求观察到1)脂肪肝炎改善且纤维化程度没有恶化,或者2)肝纤维化程度改善且脂肪肝炎没有恶化,或者3)脂肪肝炎和肝纤维化同时改善。影像学评价、血清学评价均不能作为nash药物获批上市的主要终点,进一步提高了nash药物的研发难度。
鉴于nash领域巨大的临床需求和治疗空白,evaluate pharma曾预测2025年全球nash药物的市场规模可达400亿美元。正所谓重赏之下必有勇夫,凭借该领域所蕴藏的巨大市场潜力诱惑,全球众多药企纷纷布局研发nash药物。据医药魔方数据库统计,目前全球有超180款nash新药进入临床阶段。在此之中,多款热门在研nash新药于近期公布了关键临床研究数据。
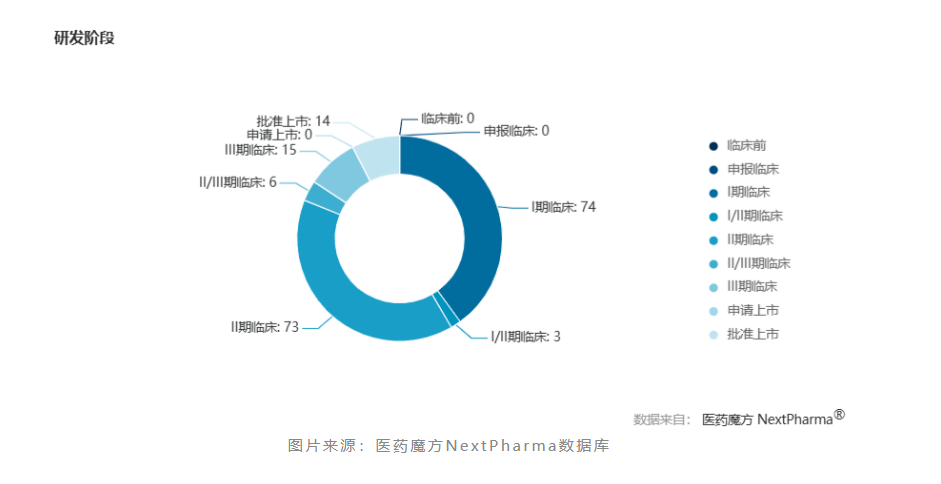
奥贝胆酸:赛道标杆,一波三折
奥贝胆酸(obeticholic acid)是intercept研发的一款特异性法尼酯x受体(fxr)激动剂,其能通过激活肝脏和小肠中的fxr来减少胆固醇向胆汁酸转化以及降低回肠对胆汁酸的摄取,从而调节胆汁酸代谢和后续的炎性反应。
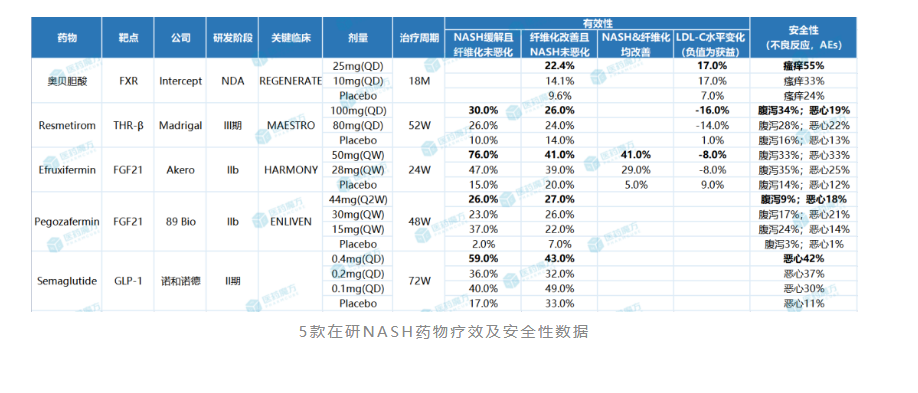
奥贝胆酸是全球首款在iii期临床中取得积极结果的nash药物。2019年2月,intercept宣布奥贝胆酸用于治疗伴有肝纤维化nash患者的为期18个月的regenerate研究中期分析取得积极结果[4]。本次中期分析共纳入了931名伴有2级或3级肝纤维化(f2~f3)的nash患者,按1:1:1比例分成三组,分别接受每日一次奥贝胆酸10mg,25mg或安慰剂治疗。该研究的主要终点为纤维化改善≥1级且nash无恶化的患者比例。结果表明,在治疗18个月时,奥贝胆酸高剂量组中23%的患者实现了纤维化改善≥1级且nash无恶化,而安慰剂组仅有12%的患者达到这一指标(p=0.0002)。
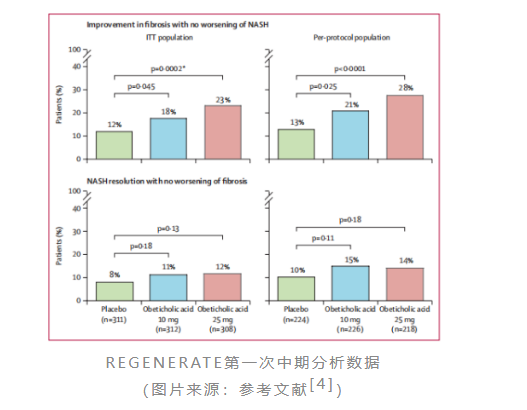
然而,在看似满意的治疗效果背后,奥贝胆酸的安全性存在着巨大的争议。接受奥贝胆酸治疗的患者出现了较为严重的瘙痒,其中高剂量组瘙痒发生率高达51%,安慰剂组这一数值为19%。此外,奥贝胆酸治疗还会导致低密度脂蛋白胆固醇(ldl-c)升高,高低剂量组发生率均为17%,而安慰剂组这一数值为7%。因此,奥贝胆酸治疗还存在着潜在的心血管风险。
基于regenerate研究结果,intercept于2019年9月向fda递交了奥贝胆酸用于治疗nash引发肝纤维化的新药上市申请(nda)。然而,2020年6月,intercept收到了fda对该nda发出的完全回复信(crl),要求intercept提供奥贝胆酸更长期的有效性和安全性数据。
随后,intercept又于2022年7月公布了regenerate研究的第二次中期分析数据。结果显示,接受治疗18个月时,奥贝胆酸高剂量组有22.4%的患者实现了纤维化改善≥1级且nash无恶化,而安慰剂组达到该指标的患者占9.6%(p<0.0001);此外,低剂量组没有达到统计学意义的改善。安全性方面,奥贝胆酸治疗所致的瘙痒仍是不可小觑的问题,其中高剂量组瘙痒发生率为55%,低剂量组为33%,而安慰剂组为24%。
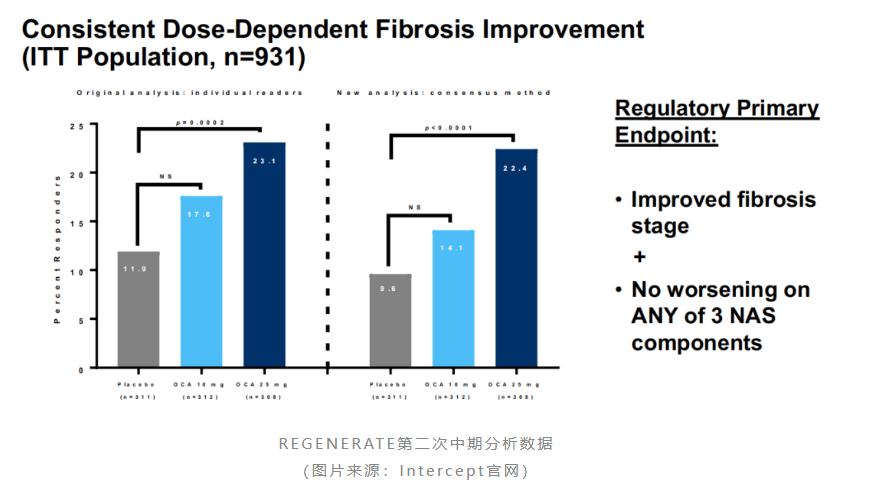
客观来看,第二次中期分析中奥贝胆酸的有效性数据仍不是足够充分,即便是高剂量组应答率也仅为22.4%。再看安全性方面,高剂量组的瘙痒发生率过半,这可能将会很大程度上影响患者的依从性。nash为代谢性慢病,患者需要长期服药,因此对用药的安全性和依从性要求会更为严格。
尽管如此,intercept还是基于上述研究结果重新向fda提交了nda。2023年1月19日,intercept宣布fda已接受奥贝胆酸治疗nash引起的肝硬化前期伴有肝纤维化患者的nda,pdufa日期定为2023年6月22日。
resmetirom:多年企盼,一朝梦圆
甲状腺激素受体β亚型(thr-β)在人体肝脏中高表达,其能够调节脂代谢,降低ldl-c、甘油三酯和致动脉粥样硬化性脂蛋白。与此同时,thr-β还可以通过促进脂肪酸的分解和刺激线粒体的生物发生来减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。因此,thr-β激动剂具备调控多种肝脏代谢通路来治疗nash的潜力。

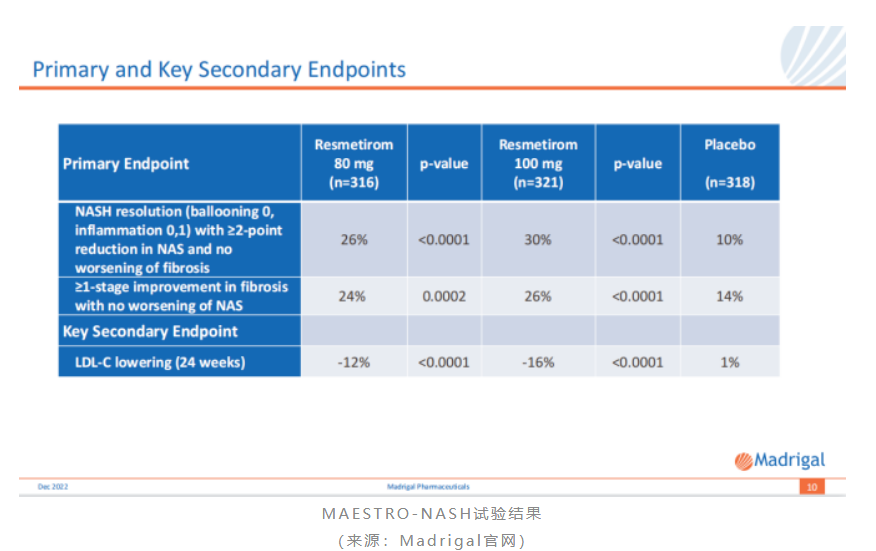
2022年12月19日,madrigal宣布从其罗氏引进的thr-β激动剂resmetirom用于治疗nash的iii期maestro-nash研究达到了双重主要终点。该研究共入组了966例患者,按1:1:1分为三组,分别接受resmetirom 80mg、100mg或安慰剂治疗。主要终点是治疗52周肝穿的组织学结果,关键次要终点为治疗24周时ldl-c降低水平。
研究结果显示,在nash缓解且纤维化不恶化的主要终点上,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%;在纤维化改善≥1级且nash不恶化的主要终点上,三个组的发生率为26%、24%、14%;在次要终点ldl-c降幅上,三个组分别为-16%、-12%、1%。这也意味着resmetirom不仅能够缓解nash,还具有降低心血管风险的治疗潜力。
与此同时,resmetirom在安全性方面也表现得十分完美,高低剂量组均显示出了良好的耐受性。最常见的不良反应是治疗初期出现的轻中度的腹泻和恶心。
maestro-nash研究的积极结果也立刻反映到了二级市场。公布结果的当日,madrigal股价大涨了268%,市值超过了40亿美元。在madrigal示范效应的带动下,国内nash“概念股”公司股价也大幅上涨,12月20当日,港股歌礼制药暴涨53%、海思科涨超7%……
基于maestro-nash研究和另一项iii期maestro-nafld-1研究的积极结果,madrigal计划于2023年上半年提交resmetirom用于非肝硬化nash伴肝纤维化治疗的新药上市申请。
如若resmetirom顺利在2023年底或2024年获批上市,madrigal同样也将面临着一个巨大的难题——resmetirom的化合物专利可能在2026年到期,未来的商业化空间可能会受到其它thr-β激活剂抢占。
根据医药魔方数据库,截至目前全球共有10款用于治疗nafld/nash的thr-β激活剂进入临床。
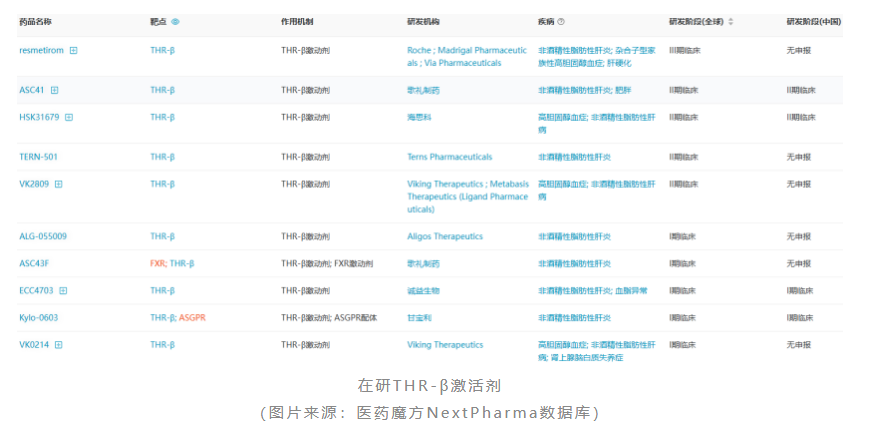
其中,vk2809是metabasis/viking therapeutics联合开发的一款用于治疗nash的thr-β激动剂,正在开展iib期voyage研究。此前披露的iia期研究结果显示,治疗12周后,与安慰剂相比,vk2809治疗组患者ldl-c水平降低,mri-pdff测量出的肝脂含量也显著降低,安全性总体良好。该公司计划于2023年第二季度披露voyage研究的肝穿刺活检组织学数据。如果数据积极,其将再次证明thr-β靶点的可行性,为该靶点的研发企业再添信心。
值得一提的是,国内歌礼制药asc41治疗nash的研究也进入了临床ii期阶段。此前披露的ib期临床数据显示,在20名超重和肥胖受试者(此类人群具有nafld特征)中,每日口服一次10mg asc41可将ldl-c水平改善37.30%~38.85%,较resmetirom的效果更为显著。
efruxifermin:
显著缓解纤维化,冲击肝硬化
成纤维细胞生长因子(fgf)是一组结构相似的蛋白质超家族,目前已知的fgf家族共有22个成员,根据系统发育相似性,这22个fgf分属于7个亚类。fgf19亚类,包括fgf23、fgf21和fgf19,是全身循化性内分泌激素。fgf19是一种内分泌胃肠激素,其可通过细胞色素p4507a1抑制胆固醇合成和抑制胰岛素诱导的肝脏脂肪生成。fgf21可以作用于不同的fgfr,介导对脂肪组织代谢的直接自分泌作用,减少肝脏脂肪和炎症,逆转纤维化,增加胰岛素敏感性并改善脂蛋白,治疗nash[5]。
efruxifermin是akero therapeutics开发的一款融合了fc片段的长效fgf21类似物,其半衰期可达到3~4天,可以实现每周1次或每2周1次皮下注射给药。
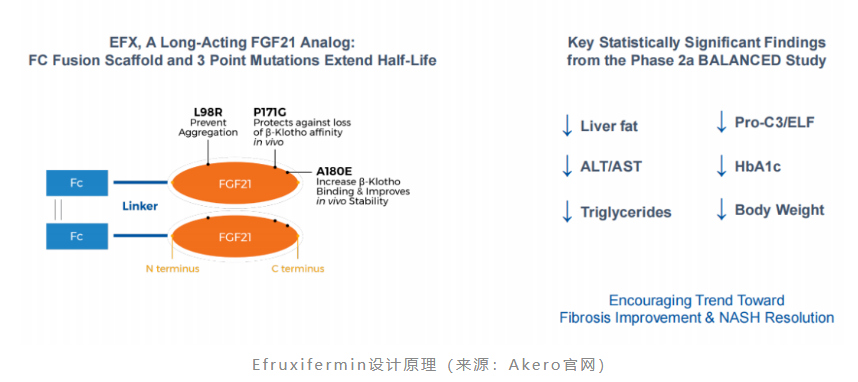
2022年9月13日,akero公布了efruxifermin治疗肝硬化前nash(纤维化f2-f3)iib期harmony研究的成功结果。数据显示,第24周时,每周一次皮下注射efruxifermin 28mg和50mg剂量组均达到了改善肝脏纤维化的主要终点,分别有39%和41%的患者实现了纤维化改善≥1级且nash没有恶化,而安慰剂组为20%。
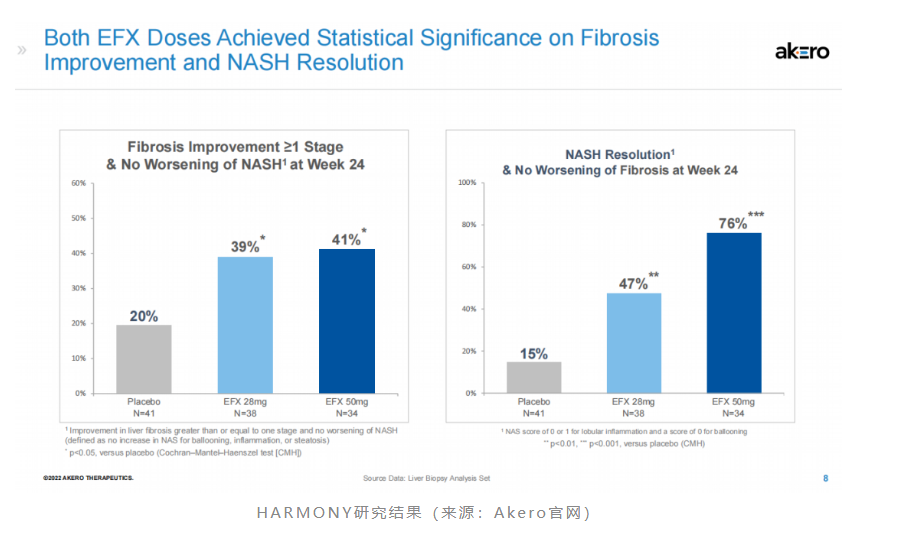
不仅如此,该研究还达到了多个关键次要终点。第24周时,高低剂量组分别有76%和47%的患者实现了nash缓解且肝纤维化不恶化,而安慰剂组为15%。另外,高低剂量组分别有41%和29%的患者达到了肝纤维化改善和nash缓解两个终点,而安慰剂组仅为5%。安全性方面,efruxifermin最常见的不良反应也是腹泻(高剂量组33%)和恶心(高剂量组33%)。基于上述的积极数据,akero已与fda就efruxifermin的iii期研究进行了细节讨论,预计将于2023年下半年开始招募患者。
特别值得注意的是,efruxifermin的组织学改善效果是迄今为止披露数据的nash药物中最为显著的。与此同时,akero也在另一项iib期symmetry研究中评估efruxifermin在代偿性肝硬化nash患者(f4)中的疗效和安全性,结果预计于2023年底公布。如若symmetry研究能再传来积极的数据结果,基于肝硬化nash人群巨大的未满足临床需求,这将为efruxifermin乃至整个fgf21赛道未来的市场前景留下无尽的遐想空间……
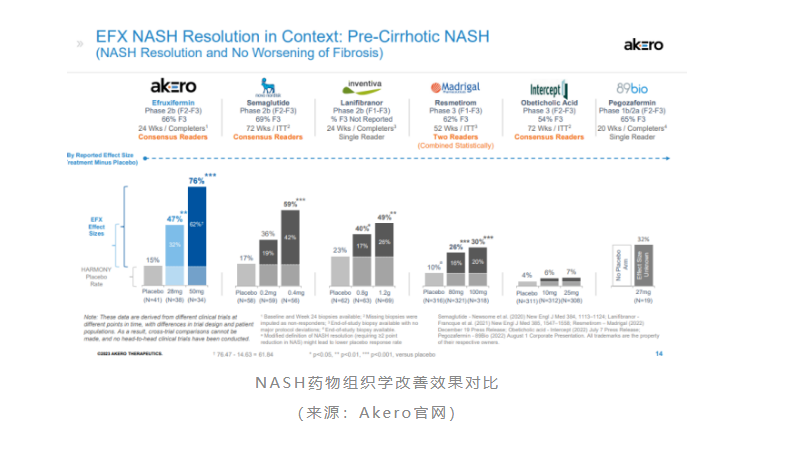
此外,89bio也于2023年3月公布了fgf21类似物pegozafermin治疗nash的iib期enliven研究的积极结果。数据显示,44mg q2w和30mg qw剂量组纤维化改善≥1级且nash无恶化的患者比例分别为27%和26%,是安慰剂组(7%)的3.5倍;44mg q2w和30mg qw剂量组nash缓解且纤维化无恶化的患者比例分别为26%和23%,是安慰剂组(2%)的12~14倍。安全性方面,pegozafermin最常见的不良反应也是腹泻(高剂量组9%)和恶心(高剂量组18%)。

相较之下,作为后来者,pegozafermin的组织学改善数据虽不敌efruxifermin,但更优的安全性和更低的给药频率仍给其留下了潜在的市场空间。
司美格鲁肽:nash也能行
司美格鲁肽是一款长效glp-1(胰高血糖素样肽-1)受体激动剂。截至目前,其已在多个国家和地区获批了2型糖尿病和减肥适应症。不仅如此,司美格鲁肽还可以够降低血脂、丙氨酸转氨酶及血清c反应蛋白等炎症标志物水平,具有治疗nash的潜力[6]。
早在2016年11月,诺和诺德就启动了司美格鲁肽治疗nash的ii期临床试验(nct02970942)。该研究为一项随机、双盲、安慰剂对照的ii期临床,共纳入了320名伴有肝纤维化(f1~f3)的nash患者,随机按1:1:1:1接受司美格鲁肽0.1mg、0.2mg、0.4mg(每日一次皮下注射)或安慰剂治疗72周。主要终点为nash改善且纤维化无恶化的患者比例,次要终点为纤维化改善且nash无恶化的患者比例,终点数据分析仅在f2~f3期纤维化患者中进行。
研究结果显示,该研究达到了nash缓解且纤维化不恶化的主要终点,高、中、低剂量组发生率分别为59%、36%、40%,而安慰剂发生率为17%;但该研究未达到纤维化改善且nash未恶化的次要终点。安全性方面,与司美格鲁肽在其它研究中的安全性基本一致,最常见的不良反应为恶心、便秘、呕吐等。基于上述积极结果,诺和诺德已于2021年启动了司美格鲁肽治疗肝纤维化(f1~f3)的nash患者的iii期研究。
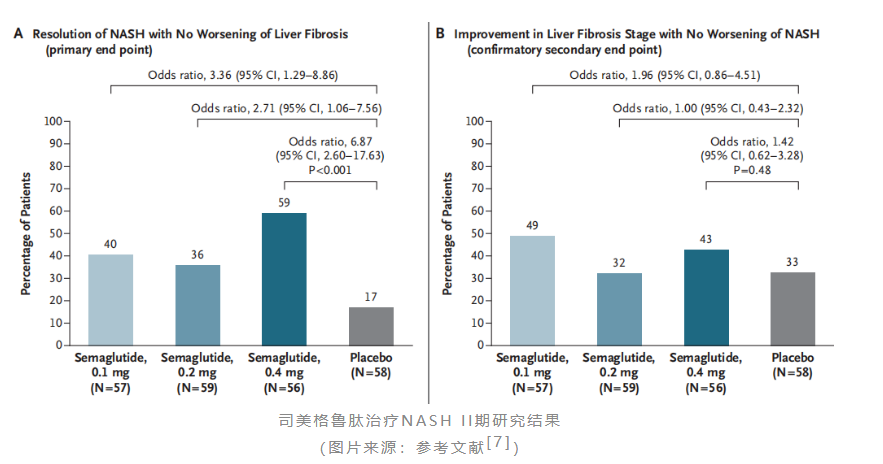
不过,诺和诺德的野心远不止如此。与akero一样,其同样也将目光投向了代偿性肝硬化这片蓝海市场。2019年,诺和诺德启动了司美格鲁肽治疗代偿性肝硬化(f4)nash患者的一项ii期临床(nct03987451)。该研究共纳入了71名bmi指数≥27kg/m²的肝纤维化患者,按2:1比例接受2.4mg司美格鲁肽或安慰剂治疗48周,主要终点为纤维化改善≥1级且nash无恶化。
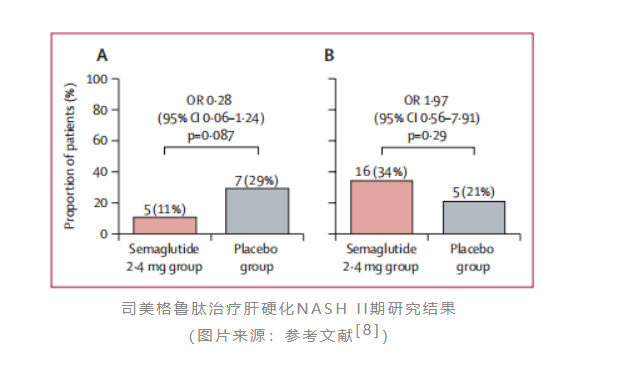
不及预期的是,诺和诺德在2022年6月宣布上述研究并未主要终点。治疗48周时,司美格鲁肽组达到主要终点的患者比例为11%,而安慰剂组为29%。但诺和诺德并没有放弃肝硬化市场,其还布局了司美格鲁肽联用吉利德cilofexor(fxr激动剂) firsocostat(acc1/2抑制剂)三药联合治疗肝硬化nash的ii期研究。但值得注意的是,此前cilofexor和firsocostat单药治疗nash的临床研究均以失败告终,该三药联合疗法的治疗潜力还有待更多的临床数据来验证。
总结
除前文提到的近期公布数据的靶点外,围绕nash治疗,还有rna干扰(rnai)疗法及ppar、scd1、ccl24、fgf19等靶点在研。随着在研产品的不断推进及技术的迭代升级,nash领域的前景将会越来越明朗。
不过相较于biotech捷报频传,多家mnc却在2023年纷纷退出nash赛道,强生将在研的rnai nash疗法aro-pnpla3全部权利交还给arrowhead;默沙东决定终止与ngm bio合作的mk-3655(ngm313)治疗nash的iib期研究;诺华也宣布终止与pliant therapeutics就整合素αvβ1抑制剂pln-1474治疗nash的合作,并全面退出nash领域。不过对于在研管线庞大的mnc来说,就某个前期项目“合作”再“分手”的事件也屡见不鲜,暂时的退出也不妨碍他们待时机成熟时再出手。
总的来说,2023年将是nash领域值得期待的一年。如若nash药物能迎来fda首批,这不仅将解决这一领域极广阔未满足的临床需求,同时也将继续点燃nash药物研发的热情,越来越多的药企以及资本也会进驻这一赛道。道阻且长,行则将至!nash这场跨越了40多年的苦战,终将迎来胜利!