t细胞工程改变了癌症免疫治疗的格局。car-t细胞在治疗血液学b细胞恶性肿瘤方面显示出显著的疗效。然而,到目前为止,它们对实体瘤的临床影响效果并不显著。表达工程化t细胞受体的t细胞(tcr-t细胞)代表了一种有前景的治疗选择。靶点不限于膜蛋白,tcrs的固有特性,如高抗原敏感性和近生理信号,可能在提高t细胞持久性的同时,提高肿瘤细胞的检测和杀伤能力。在这里,介绍了针对不同肿瘤抗原家族的tcr-t细胞的临床结果,详细介绍了为识别和优化tcr候选者而开发的不同方法,讨论了tcr-t细胞疗法的挑战(包括毒性评估和耐药机制)。最后,分享一些观点,并强调该领域的未来方向。
过去的十年,免疫疗法彻底改变了癌症的治疗管理。在短短7年的时间里,7种免疫检查点抑制剂(icis)被fda批准用于超过85种肿瘤学适应症。然而,很大一部分患者并没有从ici中受益,部分原因是肿瘤特异性效应t细胞的稀缺。这一限制可以通过过继细胞转移(act)来克服,即输注抗原特异性t细胞的数量比内源性反应观察到的要多得多。不同的act技术正在发展,包括肿瘤浸润性淋巴细胞(til)治疗、t细胞受体工程t细胞(tcr-t)细胞治疗和嵌合抗原受体t(car-t)细胞治疗。最初开发的act是基于分离肿瘤特异性til,用于体外扩增和回输到患者体内。虽然这种方法对某些癌症类型(如黑色素瘤)有效,但只适用于可切除的肿瘤,从肿瘤中可以分离和扩增足够的t细胞。tcr-t和car-t细胞疗法由基因工程t细胞组成,修饰的t细胞可以表达针对肿瘤抗原的受体。car-t细胞疗法是血液学癌症的重大突破,目前已有6种疗法获得fda批准,2种获中国批准,靶向cd19或b细胞成熟抗原。然而,car-t细胞在实体瘤中的临床疗效并不理想,存在多种障碍,包括可用抗原稀缺、肿瘤异质性或肿瘤免疫抑制。晚期实体瘤的特征还包括结缔组织增生和异常血管形成,导致缺氧和营养物质供应改变。tcr-t细胞疗法代表了一种具有多种优势的替代方案。首先,tcr-t细胞治疗的靶抗原库比car-t细胞的靶向抗原库大。事实上,由于tcr的性质,tcr-t细胞可以识别来自膜和细胞内蛋白的表位,并由主要组织相容性复合体(mhc)呈现,而car-t细胞仅限于靶向细胞表面抗原。然而,对tcr-t细胞的抗原识别仅限于呈现表位hla等位基因,从而限制了从给定的tcr-t细胞治疗中受益的患者数量。其次,tcr-t细胞诱导激活所需的表位密度低于经典car-t细胞(每个细胞分别为1-50 vs 10^3个表位)。这种提高的敏感性可能会改善肿瘤细胞的检测和杀伤力。最后,tcr-t细胞的高亲和力也可能提高其疗效,与cars相比,tcr-t细胞对靶细胞的亲和力较低,可能允许每个tcr-t细胞“扫描”并清除几个抗原呈递的肿瘤细胞。
到目前为止,tcr-t细胞治疗实体癌的令人信服的临床数据已经公布。这里对目前临床上tcr-t细胞治疗靶向的不同类型的肿瘤抗原以及在临床前阶段开发的新的有前景的抗原进行了合成。这里回顾了鉴定肿瘤特异性tcr的不同策略,并优化其表达和tcr-t细胞治疗的有效性。还讨论了需要解决的挑战,以提高这种方法的安全性和有效性。最后,给出了未来研究的一些展望,提出了有希望的策略来提高体内工程t细胞的持久性或开发同种异体方法。
临床试验中的靶向抗原的库
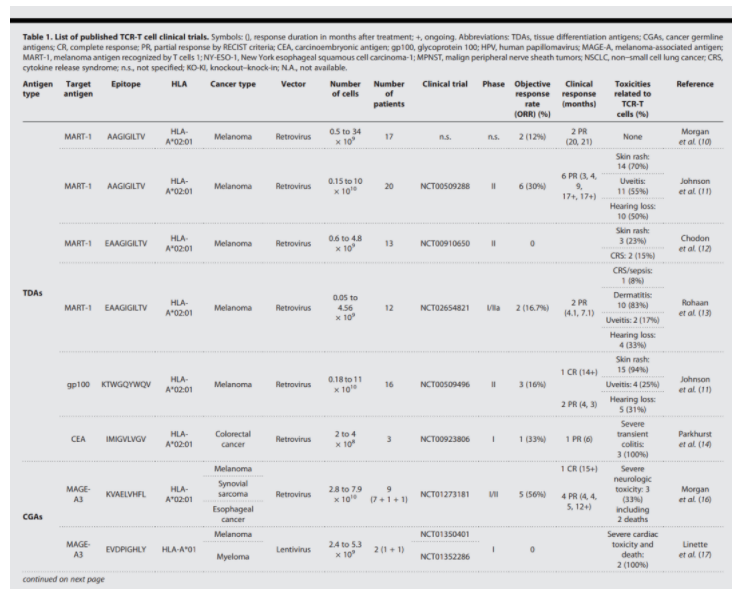
抗原选择是开发安全有效的tcr-t细胞疗法的关键。理想的抗原将在肿瘤细胞中选择性地、均一地表达,并在其表面的mhc i类分子上产生表位。目前临床试验中主要考虑两大类肿瘤抗原:肿瘤相关抗原(taa)和肿瘤特异性抗原(tsa)(图1)。已公布结果的临床试验见表1。

●图1 tcr-t细胞治疗中靶抗原的选择。(a)与正常组织相比,肿瘤相关抗原(taa)在肿瘤中过度表达,而肿瘤特异性抗原(tsa)仅在肿瘤中表达。最后一栏显示了每种抗原类型的优缺点。(b)在确定抗原之后,需要根据数据驱动的生物信息学工具(例如:netmhc和mhc flurry)预测表位,并通过多肽学/免疫表位学证实它们在肿瘤细胞中的存在。这些步骤之后是表位特异性tcr的鉴定。(int,强度;m/z,质量/电荷比)
01
肿瘤相关抗原(taa)
taas是在癌症中过度表达但在正常组织中表达有限的一种抗原。它们的表达可限于肿瘤起源的组织【组织分化抗原(tdas)】或生殖系组织【癌症生殖系抗原(cgas)】。taa是有吸引力的治疗靶点,因为它们通常在患者之间共享。然而,由于它们在正常组织中的表达,虽然水平较低,但可能与某些on-target off-tumor毒性有关。此外,在胸腺阴性选择过程中,高亲和力的特异性t细胞可能会被消除,这使得识别有效的tcr变得更加困难。
组织分化抗原(tda)
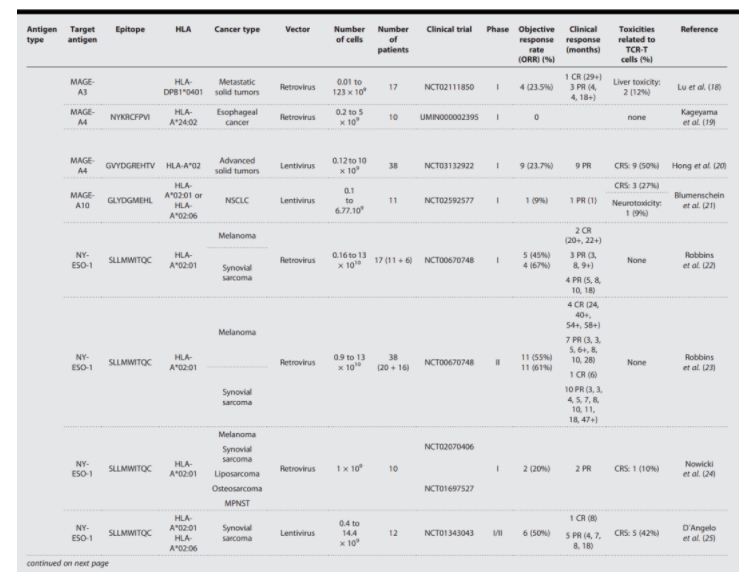
针对tda的临床试验,如t细胞识别的黑色素瘤抗原1(mart-1)、糖蛋白100(gp100)或癌胚抗原(cea),显示出一些临床反应,但由于它们在正常组织中的低表达,描述了一些毒性。在评估黑色素瘤患者mart-1特异性tcr-t细胞的第一次临床试验中,客观应答率(orr)未超过12%(2/17)。为了改善临床反应,在另外两个临床试验中测试了亲和力增强的tcr识别mart-1。尽管其中一项试验的临床反应略有改善,orr分别为30%(6/20)和0(0/13),但由于mart-1在正常黑素细胞中的低表达,出现了几种严重的皮肤、眼睛和听觉毒性。最近,一项使用不同tcr治疗mart-1的临床试验不得不提前终止,因为如前所述的严重毒性和一名患者的死亡。靶向gp100的tcr-t细胞也观察到了类似的结果。黑色素瘤患者的orr为16%(3/16),但正如先前所观察到的,报告了许多皮肤、眼睛或听觉不良事件。在这方面应该提到的是,tebentafusp,一种融合了抗cd3单链可变片段的针对gp100的可溶性亲和力增强型tcr,已被批准用于治疗hla-a*02:01阳性的成年患者,这些患者患有不可切除的转移性葡萄膜黑色素瘤,根据3期随机试验的结果,该试验显示出显著的总体生存获益。毒性大多是轻微到中度的,大多数与治疗相关的不良事件被归类为皮肤相关的(由于gp100阳性的黑色素细胞)或细胞因子介导的(由于t细胞激活)。在评估针对cea的tcr-t细胞的临床试验中,3名结直肠癌患者中的1名出现部分反应,但所有患者都出现了严重的炎症性结肠炎等副作用。其他靶点,如治疗胰腺癌的间皮素,目前正在临床上进行测试(nct04809766)。
癌症生殖系抗原(cga)
大多数针对cgas的tcr-t细胞临床试验,也被称为“癌症睾丸抗原”,都集中在黑色素瘤相关抗原(mage-a)蛋白家族的成员和纽约食道鳞状细胞癌-1(ny-eso-1)。针对来自mage-a3的两个不同mhc i类限制性表位的前两项临床试验导致了交叉反应(识别无关表位)引起的严重和致命的毒性效应。在第一个试验中,56%的患者(5/9)观察到客观反应,但mage-a3 tcr-t细胞与mage-a12(一种在大脑中表达的蛋白质)发生交叉反应,导致严重的神经毒性和2人死亡。由于心脏毒性和两名接受治疗的患者死亡,第二项试验提前停止。回顾性研究发现,mage-a3特异性tcr-t细胞也能识别肌联蛋白的表位,肌联蛋白是一种在心肌细胞中表达的蛋白质。最近,针对mage-a3的mhc-ii类限制性tcr获得了更好的临床结果,orr为25.3%(4/17),没有重大毒性。mage-a4也以tcr-t细胞为靶点。在食道癌患者的第一次试验中没有观察到临床反应。然而,最近报道了针对不同mage-a4表位(afamitestine autoleucel)的亲和力增强的tcr-t细胞,特别是在肉瘤中,结果非常令人鼓舞。在2期试验spearhead-1公布时,可评估的人群包括33名滑膜肉瘤患者和4名黏液样/圆形细胞脂肪肉瘤患者。orr为39.4%,疾病控制率为84.8%。在滑膜肉瘤患者中观察到两种完全反应。在22例(59%)患者中,细胞因子释放综合征(crs)的毒性是可控的。针对mage-a10的策略在非小细胞肺癌患者中的初步临床结果不那么令人鼓舞,因为11名患者中只有1名患者经历了短暂的部分应答(orr,9%),并且描述了包括crs和神经毒性在内的不良事件。
靶向ny-eso-1的tcr-t细胞在临床试验中显示出良好的结果,特别是在黑色素瘤和滑膜肉瘤中。在5个临床试验的107例患者中,平均有效率为47%(orr在20%~67%之间),8例完全缓解,40例部分缓解,无主要毒副作用。在最近的一项ny-eso-1 tcr-t细胞的临床试验中,使用crispr-cas9基因组编辑工具剔除了内源性tcr和pd-1。尽管在3名接受治疗的患者中没有观察到临床反应,但与研究ny-eso-1的其他试验相比,crispr工程的t细胞在体内的持久性增加(36周对1周)。虽然显示了有希望的结果,但ny-eso-1在转移性癌症中的表达仍然有限,而且它的肿瘤表达通常是异质性的。其他cgas正在进行临床试验,如kk-lc-1(nct03778814和nct05035407)或prame(nct03686124和nct02743611),尚未公布临床结果。
02
肿瘤特异性抗原(tsa)
tsa,也称为新抗原,是肿瘤细胞独有表达的蛋白质,因为它们与肿瘤发生过程(突变和病毒诱导)有关。以这些新抗原为靶点进行免疫治疗的毒性风险非常有限,因为它们不在正常组织中表达。此外,针对这些新抗原的高亲和力t细胞在阴性胸腺选择过程中不会被消除,并且可以从患者肿瘤或健康供体外周血中分离出来。
突变相关新抗原
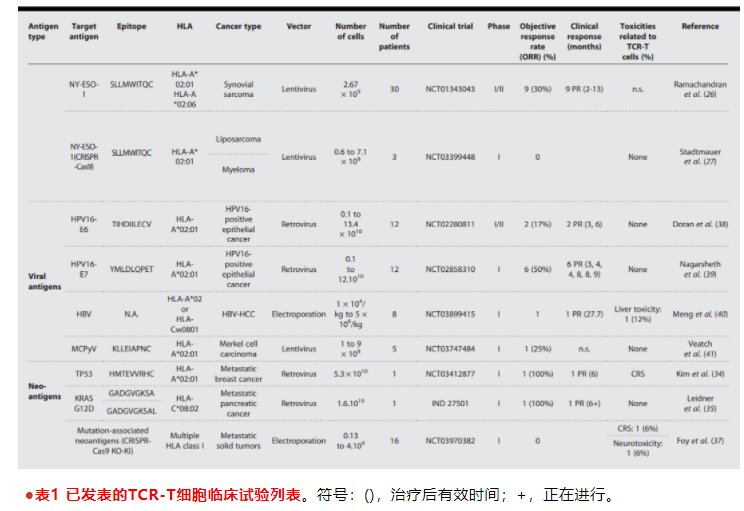
这些新抗原是由与致癌遗传事件或全球遗传不稳定相关的非同义突变引起的。“公共”新表位是指来自频繁突变的驱动基因(如tp53、kras或pik3ca)的表位,这些表位将在具有一个特定hla等位基因的不同患者之间共享。针对这些公共肿瘤抗原的tcr-t细胞目前正在进行临床试验。在最近的一项研究中,进行了一项筛选,以确定来自共享的tp53突变和相应的特定tcr的新表位。1名乳腺癌患者接受了靶向p53r175h新表位的tcr-t细胞治疗,并经历了部分反应,毒性有限。然而,患者在6个月后进展,因为i类mhc表达缺失。对于kras,进行了一项单患者研究新药应用,以评估kras-g12d特异性tcr-t细胞在胰腺癌患者中的安全性和耐受性。6个月后,肿瘤仍在消退,未发现毒性反应,功能性tcr工程t细胞于循环中持续存在。针对kras-g12v突变株(mut)的tcr-t细胞也正在临床上进行测试(nct03190941)。最后,使用筛选方法鉴定识别在hla-a*03:01患者中共享的mut pik3ca公共肿瘤抗原的tcr。在携带pik3ca-mut肿瘤的小鼠体内,工程mut pik3ca特异性tcr-t细胞显示出对已建立的肿瘤的抗肿瘤反应,但不能对抗野生型pik3ca肿瘤。综上所述,这些结果证明了靶向tcr-t细胞治疗突变癌症驱动因素的新抗原的临床兴趣。然而,识别包含带有hla的公共突变的表位限制了潜在的靶表位列表。这一问题可以通过针对因癌症遗传不稳定而不参与致癌过程的基因中发生的突变来部分解决。个性化tcr-t细胞疗法的发展具有挑战性,甚至比癌症疫苗更复杂。最近发表了一项开创性的临床研究,证明了使用crispr基因编辑来创建个性化tcr-t细胞的可行性。对于16名试验参与者,从每个人的血液中分离、克隆和验证新抗原特异性tcr。从患者自身的t细胞中删除两个内源性tcr基因,并同时插入编码所选新抗原特异性tcr的序列。随着细胞剂量的增加,患者接受了多达三种不同的tcr-t细胞。没有观察到重大的安全问题。作者发现,tcr-t细胞迁移到了肿瘤中。5名患者病情稳定,其余11名患者病情进展为最佳治疗反应。尽管临床活动适度,但这项研究为开发优化的个性化tcr-t细胞疗法铺平了道路。联合抗pd-1抗体正在临床试验(nct03970382和nct04520711)。
病毒抗原
一些癌症可由病毒感染诱发,如人乳头瘤病毒(hpv)、乙肝病毒(hbv)、默克尔细胞多瘤病毒(mcpyv)或eb病毒(ebv)相关癌症。在hpv相关癌症中表达的e6和e7病毒抗原已成为临床试验的靶点。在使用hpv16-e6特异性tcr-t细胞的第一次试验中,17%的患者(2/12)报告了临床反应,没有明显的毒性。在使用hpv16-e7 tcr-t细胞的第二次试验中,50%的患者(6/12)在治疗后9个月内观察到部分反应,没有明显的毒性反应。然而,有几位患者描述了由于抗原提呈减少而导致的肿瘤逃逸。最近,针对hbv相关性肝细胞癌的hbv特异性tcr-t细胞在临床上进行了检测。8名患者中有1名(orr,12.5%)经历了27.7个月的部分反应,并有轻微毒性。mcpyv特异性tcr-t细胞治疗pd-1抑制剂难治性转移性默克尔细胞癌的初步结果显示,25%的orr,5名患者中有1名出现不同的反应。然而,同时实施了其他有效的治疗方法,使得很难解释结果。针对其他病毒蛋白的tcr-t细胞现在正在临床上进行测试,例如ebv相关鼻咽癌中的潜伏膜蛋白(lmp1和lmp2)(nct03925896,nct04509726和nct03648697)。即使应用仅限于某些癌症,病毒抗原也受益于目前临床试验中描述的固有的肿瘤特异性,对正常组织没有毒性。此外,它们可以在患有相同病毒诱导的癌症和hla型的患者之间共享。
可选择的tsas
可选择的过程可以产生来自非编码基因组、来自交替的开放阅读框架、或来自异常转录、翻译或翻译后修饰的tsa,并且被称为“可选择的肿瘤特异性抗原”(atsa)。atsa的一个例子是突变的移码新抗原,它来自移码插入/缺失(indels)产生的多肽。发现微卫星不稳定-高肿瘤的患者共享由微卫星序列中的indels引起的肿瘤特异性移码突变。这些移码突变产生的新表位在患者之间是共享的,在体外呈现出很强的免疫原性。肿瘤抗原也可由异常的mrna剪接引起,如内含子保留或外显子-外显子连接。异常翻译也会产生atsa。例如,研究者鉴定了特定的黑色素瘤新抗原meloe-1和meloe-2,它们来自于meloe长非编码rna的内部核糖体进入位点依赖的翻译。这些新抗原在体外具有很高的免疫原性,黑色素瘤患者的特异性til已经被鉴定出来。可供选择的开放阅读框架或“非编码”序列翻译的鉴定技术的发展使所谓的“隐蔽抗原”得以发现。利用质谱仪对mhc-i类免疫多肽进行分析,估计隐蔽抗原约占白血病患者mhc i类表位的10%。最近,unannotated proteins expand the mhc-i-restricted immunopeptidome in cancer对29个初级健康和癌症样本和细胞系进行了核糖体图谱分析,以创建一个用于ms鉴定隐蔽抗原的数据库。结果表明,新的或未注释的开放阅读框架(nuorf)在10个癌症样本中占mhc i类免疫多肽的1.5-2.2%,其中50%的nuorf存在于1个以上的样本中。反转录元素也构成atsa的来源。人类内源性逆转录病毒(herv)是由古老的逆转录病毒感染产生的,占人类基因组的8%。在正常组织中,herv通常在表观遗传学上是沉默的,但在肿瘤中由于dna去甲基化,herv可以重新激活。一些herv仅在肿瘤中表达,如肾细胞癌(rcc)中的herv-e。在表现出临床前抗肿瘤活性后,herv-e tcr-t细胞现在正在临床上用于肾癌患者的测试。虽然没有这些非常规抗原的临床数据,但这些发现增加了tcr-t细胞治疗的潜在靶向肿瘤抗原的保留范围。
tcr识别和优化
鉴于tcr库的范围以及tcr与肽-mhc(pmhc)复合体相互作用的特点,对表位特异性tcr的鉴定是复杂的。事实上,据估计,一个tcr可以识别多达10^6个不同的表位,一个表位可以被多个tcr识别。pmhc特异性tcrs的识别技术是基于在特定的hla环境下体外诱导t细胞反应的基础上的。t细胞可以直接从肿瘤或患者或健康捐赠者的血液中分离出来。第一步通常包括对t细胞进行抗原刺激(t细胞启动),以在克隆扩增后用抗原特异性t细胞富集群体(图2a)。然后,表位特异性t细胞可以在体外进行分离和扩增。经快速扩增cdna末端-聚合酶链式反应,分离的t细胞可通过tcrα和tcrβ测序来确定tcr序列。最近,一些小组结合vdj测序和来自imgt的参考序列来鉴定功能tcr。针对tcr序列的单细胞rna测序(scrna-seq)的发展也促进了从启动的t细胞中识别tcr。将sctcr-seq与深度测序相结合,以确定抗原刺激后表达高水平激活标记的t细胞的tcr序列,从而在该过程的早期选择高功能的tcr。条形码四聚体、条形码抗体和scrna-seq的组合允许识别具有多肽特异性激活特征的功能性tcrs。这些技术的发展开辟了通过在抗原提呈细胞(apc)中转导串联微基因或通过用多肽库脉冲刺激apcs来同时识别不同表位特异性tcr的途径。此外,具有人源化t细胞库的活体小鼠模型的最新进展创造了在活体启动/接种后识别人类表位特异性tcr的新机会。这些模型的一个优点是,在缺乏抗原表达阻止了阴性胸腺选择的动物中,识别高亲和力tcr的可能性增加。然而,从人t细胞中识别tcr可能会限制选择自身反应性t细胞的风险。
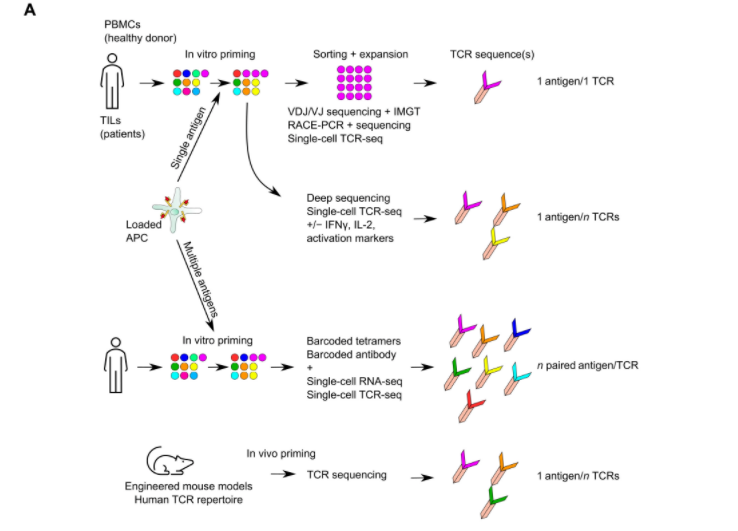
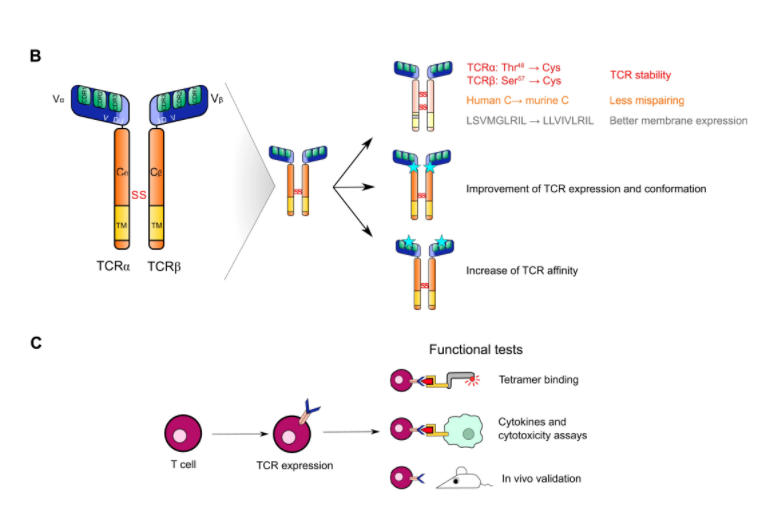
●图2 tcr识别、优化和验证。(a)来自健康捐献者的外周血单核细胞(pbmcs)或患者til的t细胞可由负载一个或多个表位或抗原的抗原提呈细胞(apc)激活和扩增,以刺激特定t细胞的激活和扩增。来自这些特定t细胞的tcr可以通过对t细胞群或单个细胞进行测序来识别。race-pcr法,快速扩增cdna末端-聚合酶链式反应。(b)可以通过修改tcrα和tcrβ链的恒定区来进行tcr优化,以防止错配,增加tcr的表达和稳定性。最近,可变区但在cdr区外的突变被证明可以改善tcr的表达和稳定性。tcr亲和力成熟的目的是提高tcr亲和力。(c)一旦确定了tcr,体外和体内功能分析验证了工程t细胞的特异性和有效性。
一旦确定了tcr序列,通常进行优化以提高tcr的表达和/或亲和力(图2b)。例如,由于在胸腺选择期间消除了针对这些自身抗原的高亲和力t细胞,某些taa特异性tcr可能具有低亲和力。由于t细胞杀伤活性依赖于tcr亲和力,因此人们开发了不同的方法来提高tcr亲和力,如随机突变pmhc识别位点、噬菌体展示、或用靶表位免疫人源化小鼠以鉴定高亲和力的tcr。然而,提高tcr的亲和力是一把双刃剑。t细胞清除呈现感兴趣表位的肿瘤细胞的能力取决于免疫突触的细胞毒反应和tcr-pmhc相互作用的不稳定性,tcr-pmhc相互作用允许t细胞连续清除几个靶点。亲和力太强的tcr可能会导致靶抗原识别后t细胞的提前耗尽,限制了后续的肿瘤细胞识别。此外,修改tcr序列还可以绕过胸腺中发生的阴性选择,从而产生与自身抗原意外的交叉反应,如下所述。
tcr的高表达和正确组装也是tcr-t细胞产生的关键。最近的工作强调了整体tcr构象的重要性,特别是在适当的tcr表达中可变区和恒定区之间的相互作用。framework engineering to produce dominant t cell receptors with enhanced antigen-specific function证明了tcr表达和组装的高度变异性,尽管初始特征相同,但依赖于变量和恒定区之间结构界面的特定残基。用最佳氨基酸取代特定位置的次优残基导致tcr表达水平的均质化。没有解决对tcr特异性的影响。其他tcr序列工程可以提高外源/转基因tcr在t细胞中的表达和稳定性。rosenberg的团队强调,这些修改增加了工程t细胞的功能(图2b)。用相应的小鼠恒定区替换人的tcrα和tcrβ链的恒定区对于避免错配至关重要,并且在临床上不会导致毒性。事实上,如果没有这些替换,外源tcrα和tcrβ链可以分别与内源tcrβ和tcrα链配对,导致新的和潜在的交叉反应tcr的产生。在小鼠恒定区中添加第二个二硫键增加了外源tcr在膜上的稳定性,而在α链跨膜区中添加疏水序列有助于膜表达。
最近,利用crispr-cas9技术的新方法被用转基因tcr取代内源tcr。内源性α和β链的基因敲除(ko)绕过了错配问题,并防止与cd3复合物与内源性tcr的竞争结合。然而,尽管到目前为止还没有在使用基因组编辑的临床试验中描述严重的不良事件,但最近的发现突显了在使用crispr-cas9技术时仔细评估基因组完整性的必要性。内源性tcr ko可以与不同的基因传递方式相结合,通常使用逆转录病毒或慢病毒载体。这些病毒方法导致tcr转基因的n个拷贝随机整合到宿主基因组中。使用同源dna修复而不是慢病毒转导对t细胞受体α恒定区(trac)位点处的转基因tcr进行敲入(ki),将转基因拷贝数限制为1,从而产生更同质的产物,降低了致癌遗传事件的风险和转基因tcr的生理表达。然而,这种方法的插入率非常低(t细胞的5%到10%)。最近,通过crispr-cas9技术内源性tcr ko与腺相关病毒(aav)转导相结合,在trac位点对tcr转基因进行了ki。这使得能够显著提高插入率(cd3 t细胞的60%到70%),同时保持外源tcr的生理表达。这些ki tcr-t细胞在体内表现出功能亲和力增强和交叉反应减少。这些结果类似于在car-t细胞上获得的结果,其中通过aav载体在trac位点插入car转基因增强了car-t细胞的效力。它还诱导了受体的有效循环,导致了工程t细胞的延迟耗尽。非病毒基因传递正在迅速发展,有望实现更快、更便宜的开发,一次修改多个内源基因的可能性以及更高的安全性。在最近发表的non-viral precision t cell receptor replacement for personalized cell therapy报道了个性化tcr-t细胞工程,利用crispr-cas9技术去除了两条tcrα和tcrβ链,并采用非病毒方法同时插入了新抗原特异性tcr的序列,ki效率达到23%(范围为11.4%~46.8%),并在研究过程中进行了优化。
所选的t细胞工程策略需要在功能分析中进行验证,以评估tcr-t细胞在体外和体内的效率和安全性(图2c)。多聚体结合分析可验证正确的tcr组装和构象。在靶细胞和肿瘤细胞共培养实验中,通过评估细胞毒性和细胞因子释放,可以评估tcr-t细胞的有效性、特异性和亲和力。在工程小鼠模型中给予tcr-t细胞是验证tcr-t细胞在体内的活性、功能性和持久性(肿瘤细胞渗透和记忆室的形成)的先决条件。t2evolve联盟的两份出版物对所有可用于评估疗效和安全性的模型和选项进行了详细的审查。
tcr-t细胞治疗面临的挑战
01
毒性评估
临床上已经描述了与tcr-t细胞相关的几种毒性。on-target off-tumor毒性与正常组织中靶抗原的表达有关,并且主要与taa有关。在针对tcr-t细胞疗法的mart-1和gp100的临床试验中,眼睛、皮肤和听觉的毒性是由于黑素细胞中taa的表达。另一项研究描述了以cea为靶点的tcr-t细胞治疗严重急性结肠炎的患者,因为它在正常肠道细胞上表达。对tcr-t细胞相关on-target off-tumor毒性的评估包括转录和蛋白质组数据库的生物信息学分析、免疫学,以及评估tcr-t细胞识别正常细胞或组织的能力的体外或离体试验(图3a)。针对pmhc复合体的car-t细胞的最新发展也可能允许开发pmhc特异性抗体,用于组织学评估肿瘤和正常组织中的表位呈递。
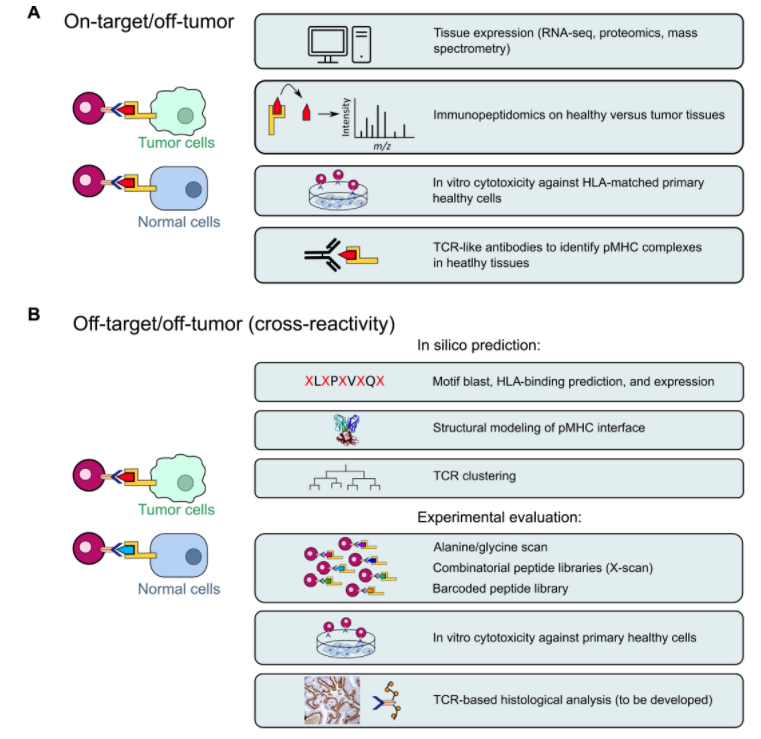
●图3 评估tcr-t细胞疗法潜在毒性的方法。(a)预测on-target off-tumor毒性的方法(正常组织中靶标表位的存在)。(b)预测off-target off-tumor毒性的方法(正常组织中存在交叉反应表位)。
off-target off-tumor毒性或交叉反应与tcr识别正常细胞上不同于靶向抗原的抗原有关。如前所述,使用亲和力增强的tcr-t细胞的临床试验中已有交叉反应的报道。事实上,针对mage-a3的tcr-t细胞也识别来自mage-a12或肌联蛋白的表位,导致4名患者死亡。因此,有必要包括一项在临床前水平评估tcr交叉反应的策略,特别是当tcr序列已被修改以提高亲和力时(图3b)。交叉反应表位的初步评估可以包括用丙氨酸残基(丙氨酸扫描)连续替换每个肽残基,以确定tcr-pmhc相互作用所必需的残基。生物信息学还可以将这些基本残基定义为9-mer或10-mer表位的5到6个氨基酸的任意组合。然后,针对人类蛋白质组,对由必需氨基酸组成的多肽基序进行冲击,以识别其他包含类似基序的蛋白质,这些基序可以作为结合hla分子的表位。该方法成功地回溯鉴定了mage-a3和肌联蛋白表位之间的交叉反应,这些表位与致死性心脏毒性有关。然而,它没有考虑到相同位置的残基被具有相似物理化学性质的氨基酸取代而产生的交叉反应。在此背景下,其他团队开发了一种突变定位扫描(x-scan),其中每个表位残基被其他氨基酸连续替换。对于每个阳性匹配,然后在人类蛋白质组中搜索肽谱,以识别潜在的交叉反应多肽。还开发了无偏方法来评估tcr的交叉反应性。位置扫描合成组合文库(ps-scl)由数以万亿计的多肽组成,其中每个天然氨基酸连续固定在每个位置,其余的多肽由所有其他现有氨基酸的随机组合组成。ps-scl筛选的结果随后与蛋白质数据库进行比较,以预测潜在的交叉反应表位。
最近的研究使用多肽库和条形码四聚体进行高通量筛选,以测试选定的tcr对人类蛋白质组中数千个多肽的识别能力。尽管功能强大,但这些筛选只能评估整个蛋白质组中表位的子集的交叉反应。基于pmhc-tcr复合体的3d建模和结构引导分析的其他策略被开发,单独或与先前的方法相结合,以尽可能准确地考虑整个蛋白质组来预测潜在的交叉反应。结构导向设计已经被用于优化tcr亲和力,使用x射线晶体结构数据集来训练预测算法,而对特异性的影响有限。相反,使用结构指导设计来提高tcr特异性(限制交叉反应),而不改变tcr亲和力。其他小组收集了已知交叉反应和晶体结构的数据集,以改进3d结构模型,从而能够基于tcr-pmhc界面处的静电表面的相似性来预测交叉反应。利用tcr-pmhc界面的另一个数据集来开发和训练一种算法,该算法证明了tcr与具有类似物理化学性质的多肽的交叉反应与pmhc复合体的结构灵活性有关。最近,一种基于深度学习的预测算法成功地预测了高灵敏度的交叉反应。结合3d建模工具和条码多聚体相关的肽库,确定了tcr指纹和潜在的tcr-pmhc相互作用的表位基序。观察到针对同一表位的不同tcr大多有不同的指纹,这表明每个tcr-pmhc相互作用都应该被认为是唯一的。这一概念受到了一些研究的挑战,这些研究试图确定针对相同表位的tcr内的相似性(tcr聚类),其中利用互补决定区域(cdr)的相似性来重新组合tcr。由于这些研究旨在预测特定tcr的抗原,它们可能为评估交叉反应提供有用的信息。尽管如此,这些预测性方法的临床验证尚未发表。需要利用现有的tcr-pmhc数据库,如atlas,以提高这些模型的预测准确性。其他和补充方法,如对原代细胞系上的tcr-t细胞毒性评估或对不同组织中原位存在的pmhc复合体的评估(免疫肽组学和基于tcr的组织学分析)也可能有助于预测毒性。必须实施合理的tcr优化概念,考虑tcr亲和力和活力以及tcr-t细胞的效率和安全性。
02
耐药机制
已经描述了对基于tcr的免疫疗法的原发性和继发性耐药机制。主要的耐药机制可能主要表现为靶抗原在肿瘤细胞中的低表达或异质性,或肿瘤细胞对t细胞介导的细胞毒的内在抵抗力。另一个可能的问题是,在体外扩增步骤之后,大多数具有晚期记忆表型的t细胞,导致比注入具有干细胞样或早期记忆表型的t细胞更疲惫和更少的持久性。对于tcr-t细胞,继发性或获得性耐药机制是主要关注的问题。肿瘤细胞表面免疫检查点配体的上调可通过激活免疫检查点受体而损害转移的t细胞的扩增和功能,导致衰竭。tcr-t细胞治疗的主要逃逸机制是肿瘤细胞表面mhc-i类分子的丢失或减少,阻止tcr-t细胞识别靶表位。mhc-i类基因表达的缺失可能由不同的机制引起,包括hla基因本身的缺失或突变、β2m或与抗原提呈有关的基因突变、杂合性缺失或肿瘤细胞中hla基因的表观遗传沉默。在tcr-t治疗过程中,hla阴性的肿瘤细胞将被阳性选择。hla杂合性缺失(hla loh)最近在两个临床试验中被描述,该试验使用针对kras或p53突变新表位的til。另一项针对乳腺癌患者的p53突变的临床试验显示,在tcr-t细胞治疗6个月后复发,肿瘤细胞表达完整的p53,并呈现6号染色体的杂合性缺失,其中包含hla-a*02:01位点。在一项临床试验中也描述了hla基因的表观遗传沉默,在复发后,肿瘤测序没有发现突变或杂合性缺失,但用去甲基化药物azacytidine治疗恢复了hla分子的表达。最近一项针对hpv-16 e7抗原的tcr-t细胞在hpv-16 上皮性肿瘤中的临床研究表明,对t细胞治疗的抵抗涉及抗原提呈过程和干扰素途径的几个因素,其中一名患者表现出tap1、tap2和ifngr的缺失。无反应或复发的患者也显示出hla-a*02:01表达受损。
展望:t细胞工程的下一步
随着tcr-t细胞疗法的发展成为一种有前景的工具,可以靶向实体肿瘤中的广泛肿瘤抗原,许多障碍仍然存在,需要克服,如t细胞介导的毒性、耐药机制和可及性。为了限制t细胞激活对正常细胞的风险,理论上可以应用为car-t细胞建议的逻辑门策略,其中t细胞的激活或抑制由两个信号而不是一个信号的整合来决定。逻辑门a和b基于组合抗原识别,只有在肿瘤细胞同时表达a和b抗原的情况下才会触发t细胞的激活。在“a非b”逻辑门中,除了靶向抗原a之外,表达肿瘤细胞上缺失的抗原b的正常细胞也受到保护。与car相比,这种方法对tcr来说更具挑战性,尤其是对于a和b,但最近开发了抑制信号平台(a非b)。自杀基因系统的目的是在工程t细胞中创造一个杀死开关作为一种保障机制,也是阻止意外不良事件的有效策略。
如上所述,除了毒副作用外,tcr-t细胞疗法还面临许多影响其有效性的耐药机制。tcr工程t细胞与icis联合治疗可避免t细胞耗尽。在一项针对p53新抗原的临床试验中,一些患者在输注后观察到高比例的pd-1抗原特异性t细胞后服用pembrolizumab。另一项临床试验正在测试mcpyv tcr-t细胞和抗pd-1/pd-l1治疗之间的组合。还有将自体抗原特异性t细胞的act与ctla-4的阻断相结合,显示了持久的临床反应,尽管患者分别对这两种治疗方法都无效。最后,为克服肿瘤相关免疫抑制而开发的用于car-t细胞治疗的基因修饰也可用于tcr-t细胞,如pd-1破坏、pd-1-cd28嵌合结构或显性抑制tgf-β2。除了合成生物学,结合针对肿瘤微环境的方法或抗肿瘤中普遍存在的低氧和酸性条件的改良细胞因子可能会提高过继t细胞疗法的效率。
t细胞治疗临床试验中面临的主要障碍之一是过继转移的t细胞持续时间较短,这与工程t细胞的快速耗尽有关。在输注时产生具有干细胞记忆表型(tscm)的工程t细胞可以改善t细胞在体内的持久性和长期的抗肿瘤疗效。可以从幼稚的前体细胞开始在体外分化和扩增tscm。t细胞培养上清液中加入il-7和il-15可使cd45ra cd45ro ccr7 cd62l cd95 il7ra 的tscm扩增。il-21还可以支持t细胞在扩增过程中的tscm表型。虽然il-2在扩增阶段维持tscm表型的效率较低,但接受过继t细胞治疗的患者可以注射il-2以支持t细胞在体内的增殖和存活。
到目前为止,tcr-t细胞疗法的发展依赖于自体t细胞工程。与car-t细胞类似,开发同种异体方法将有许多优势,例如立即可用、产品可能标准化、多细胞修饰的时间、更容易修改和降低成本。通过同时删除内源性tcrα和tcrβ链,将转基因tcr插入到trac位点将避免移植物抗宿主病的风险。这项技术应与限制宿主免疫系统对同种异体t细胞的排斥反应的策略相结合,如部分匹配或基因编辑(hla i类缺失结合自然杀伤细胞抑制)以产生通用t细胞。
总之,tcr-t细胞疗法已经在实体肿瘤中显示出非常令人鼓舞的结果,包括对目前的免疫疗法反应不佳的癌症,如肉瘤。这一治疗策略的复杂性与许多挑战有关。然而,更好地选择tsa和优化t细胞工程应该在提高抗肿瘤疗效的同时降低毒性风险。与能够改善t细胞归巢(溶瘤病毒和放射治疗)或提高输注的t细胞的活性和持久性(检查点抑制剂、细胞因子和癌症疫苗)的治疗方法相结合,可能会进一步提高tcr-t细胞的治疗潜力。可以期待这种方法,就像下一代car-t细胞一样,将改变冷肿瘤的自然史,并为巨大的治疗需求提供尊龙凯时app的解决方案。
参考文献:
r. c. larson, et al. car t cell killing requires the ifnγr pathway in solid but not liquid tumours. nature 604, 563–570 (2022).
j. a. beaver, r. pazdur, the wild west of checkpoint inhibitor development. n. engl. j. med. 386, 1297–1301 (2022).
v. leko, s. a. rosenberg, identifying and targeting human tumor antigens for t cell-based immunotherapy of solid tumors. cancer cell 38, 454–472 (2020).
m. mallet, et al. tumour burden and antigen-specific t cell magnitude represent major parameters for clinical response to cancer vaccine and tcr-engineered t cell therapy. eur. j. cancer oxf. engl. 171, 96–105 (2022).
k.-y. ma, et al. high-throughput and high-dimensional single-cell analysis of antigen-specific cd8 t cells. nat. immunol. 22, 1590–1598 (2021).
a. antoñana-vildosola, s. r. zanetti, a. palazon, enabling car-t cells for solid tumors: rage against the suppressive tumor microenvironment. int. rev. cell mol. biol. 370, 123–147 (2022).
a. d. nahmad, et al. frequent aneuploidy in primary human t cells after crispr–cas9 cleavage. nat. biotechnol. 40, 1807–1813 (2022).
estelle baulu
baulu, e., et al. tcr-engineered t cell therapy in solid tumors: state of the art and perspectives. science advances, 9(7) (2023).
m. arnaud, et al. sensitive identification of neoantigens and cognate tcrs in human solid tumors. nat. biotechnol. 40, 656–660 (2021).