近日,北京大学第一医院国家药物临床试验机构管理委员会副主任崔一民教授团队在nature reviews drug discovery上回顾了过去10多年来中国创新药物发展趋势,以下是综述内容。

由于近十年来的监管改革,我国新药临床研发和监管审查的进程发生了实质性变化。这些改革旨在鼓励开发创新产品,特别是针对罕见、严重或危及生命的疾病,并确保患者能够及时获得这些治疗。为了评估这些工艺修改的效果,本文分析了2010-2020年中国批准的创新药物的审批(ind)和新药申报(nda)的数据。
1
2010-2020年新药趋势
首次ind申请的数量急剧增加。2010-2020年共提交创新药物首次ind申请1636个,年均增长率为32 % (图1a)。其中,1410种药品(86 %)来自本土689家公司。值得注意的是,2017年创新药物首次ind申请数量较2016年增长78 %,其中化学品和治疗性生物制品分别增长60 %和159 %。
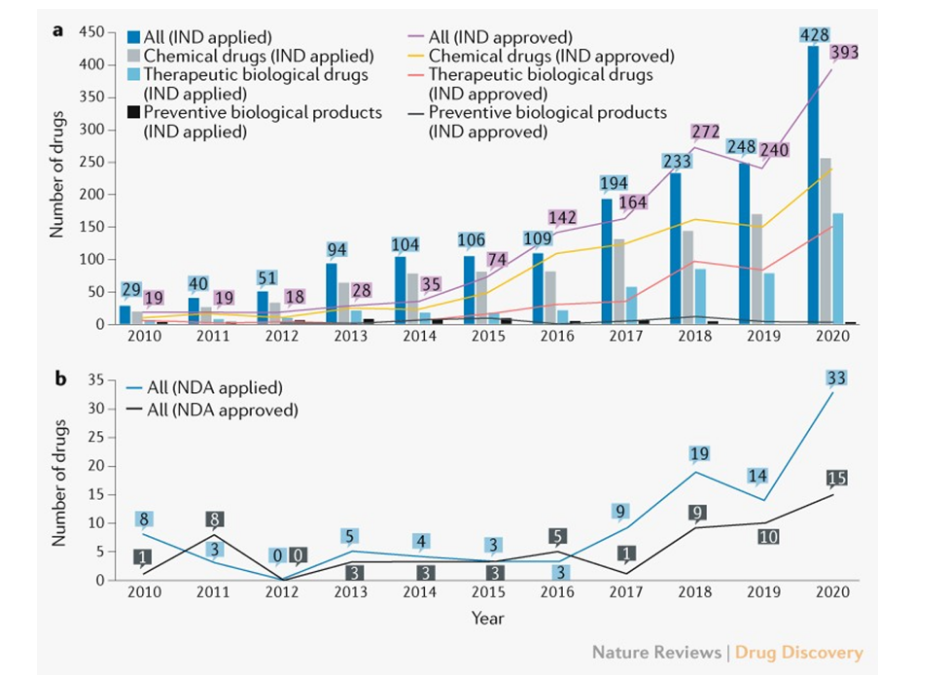
图1. 中国创新药物inds和ndas年度数量
回顾已经完成的1466个首次ind申请,1404个(96%)被批准。那些被拒的原因主要包括:申请缺乏研究信息支持,导致的沟通交流问题,和药物临床效益-风险比不合理,违反临床诊断基本原则等。首次获批ind的创新药物数量年均增长35%,2016年首次获批ind的创新药物数量显著增加。与2015年7月我国监管改革措施出台的时机一致,首次申请和批准的创新药物inds数量显著增加,缓解了申请积压,鼓励了药品创新。
批准用于创新药物的ndas数量虽少,但仍在增长。2010~2020年,我国共提交101种创新药物的ndas,其中58种创新药物获得批准。近年来,国家发改委提交和批准的数量总体呈上升趋势(图1b ),2015年7月以来批准的58种创新药物中,有42种(72 %)获得批准。回顾66个首次nda评审申请,有58篇(88%)获得批准。申请被拒发生的主要原因是药物或临床研究设计的重大缺陷、不同发育阶段使用的调查样本不一致以及检查中发现的临床试验数据不真实。
在批准的58种创新药物中,37种为中国国家医药产品管理局(nmpa)批准的新分子实体(nmes),21种为国外已批准或上市的药物,或传统疫苗、血液制品、细胞因子等。此外,14种(24%)是孤儿药,其中13种是符合美国fda标准的孤儿药。此外,40种创新药物(69%)得到优先审查,其中35种(88%)在2015年7月后获得批准。数据表明,监管改革措施,如2015年8月出台的优先审查,是为了鼓励各组织进行创新。
肿瘤是创新药物的主要领域,且大多处于早期发展阶段。首批获批ind申请的创新药物主要治疗类别为肿瘤(864, 62%)、感染( 166, 12%)、内分泌紊乱(72, 5%)和心血管疾病(60, 4%)。2016年批准首次ind申请的肿瘤药物数量明显增加,增长率为133 %。
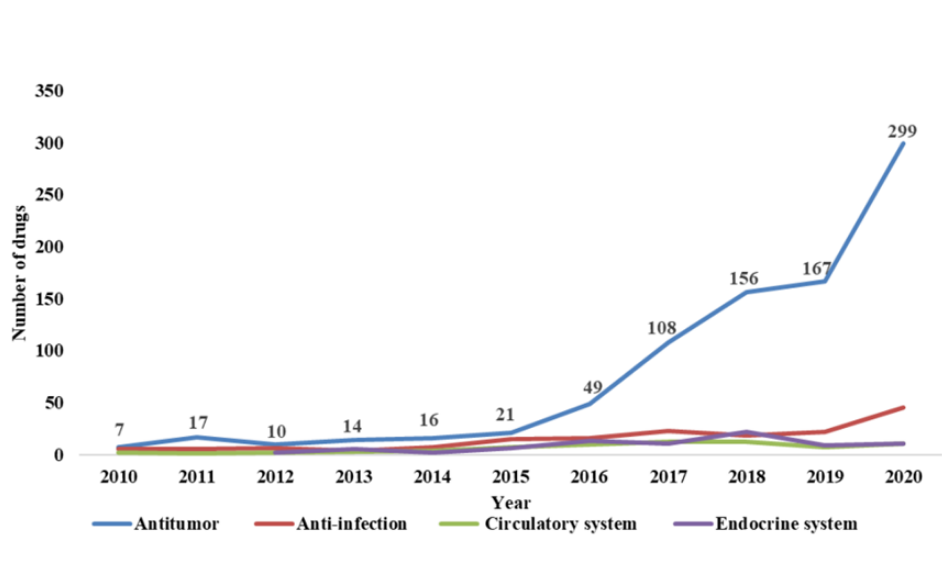
图2.2010-2020年我国创新药物治疗类别趋势
首批获批ind申请的创新药物中,705种(50%)已达到至少ⅰ期,286种(20%)和108种(8%)分别达到ⅱ期和ⅲ期。大部分抗癌药物(57%)尚未进展到ⅰ期以上(图3a)。
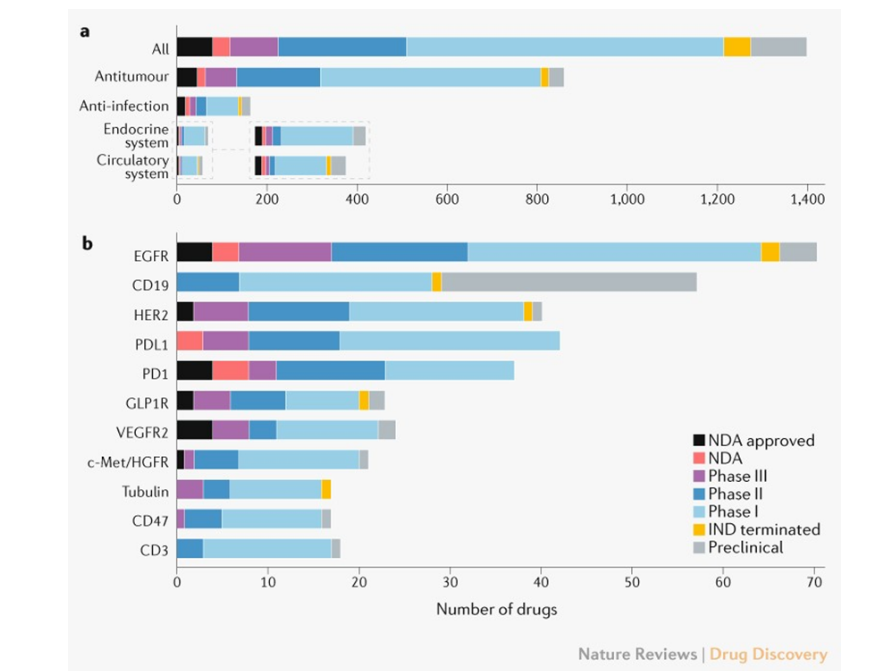
图3.我国创新药物的发展状况。a,主要治疗类别。b ,药物靶点。药物要么针对单一靶点,要么针对多个靶点
这一阶段,我国主要处于快速跟进、渐进式创新阶段,获批ndas的创新药物只有3种‘firstin class’,分别是苯烯莫德(benvitimod)、寡甘露酸钠(sodium oligomannurarate)和罗沙司他(roxadustat)。靶向egfr、pdl1和her2的药物有40多种(图3b),其中egfr获批药物最多,有4种,已达到临床试验的药物最多,有64种。同时也能看出,多个具有相同靶点和适应症的药物将降低创新效率。
ind和nda批准的速度增加,但临床试验的速度没有增加。如图4所示,改革后(2015年 7月至 2020年12月)的ind审批时间比改革前(2010年 1月至 2015年6月)缩短了414天。同样,改革后药品的nda审批阶段比改革前缩短了441天,从原来的924天缩短到了483天。

图4.2010-2020年期间批准的创新药物阶段长度
2018年7月,nmpa将药物临床试验开始审批流程调整为默示许可制度。从整体临床试验阶段的时间来看,2 572天对比原来的2 688天,两个阶段的差异并不显著,而在改革后阶段,获ind批准后的第一个受试者参加临床试验的时间比改革前延长了59天,从原来的269天延迟到328天(图4 )。提高临床试验效率是我国鼓励创新的重要改革方向。然而,这受到伦理审查效率、调查员经验和临床试验资源等多重因素的影响,需要国家临床试验能力的战略提升来应对。此外,具有相同靶点和适应症的药物目前集中在同一临床试验阶段,加重了对临床试验效率的影响。
2
展望
中国的监管改革促进了地方医疗创新。核准的ind和核准的ndas数量的趋势以及核准这些申请的时间变化表明,这些变化的影响总体上是有益的。然而,单一靶点的多个产品的扎堆和低效的临床试验过程将影响真正有意义的创新药物从ind到nda的批准进程。
参考文献:naturereviews drug discovery (nat rev drug discov) issn 1474-1784 (online) issn1474-1776 (print)