作为成药性评估(可开发性评估)非常重要的维度,蛋白自相互作用有着举足轻重的地位,那些具有高自相互作用的分子,容易导致大分子聚集或颗粒,产生非特异性吸附,也与体内半衰期短、高免疫源性相关, 对工艺开发的开发和维持良好的稳定性造成巨大挑战。
作为这个系列的开篇,选择了先讲方法论,让各位读者能直接应用到实际案例中
首先辨析一组概念,当我们再进行稳定性评估时,常会得到一组概念,胶体稳定性和构象稳定性,目前市面上也有一些集成设备将测定tm、tagg、tsize等参数的融合到一起,进而告诉我们tm是用于评估构象稳定性,tagg可用于评估胶体稳定。前者是正确的,tm是折叠展开一半时的温度,可以判断构象稳定性;但后半句也对也不对,部分可以反应折叠状态下聚集情况,但主要的还是蛋白解折叠后的聚集情况,。而真正治疗性蛋白药物,主要还是在低温保存,热解折叠部分比较少,或许会有部分化学解折叠,但更主要还是本身的自相互。
如图1所示,本系列会更集中介绍native条件下的自相互作用。
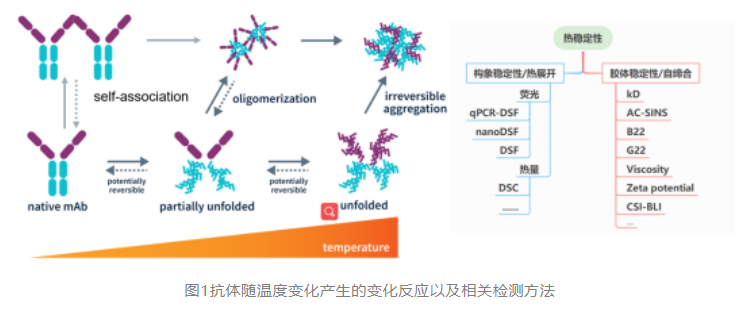
溶液中蛋白质-蛋白质相互作用(ppi)的重要贡献者是氢键、空间(不包括体积)、静电、范德华和疏水相互作用。可见可以有多个维度去评估这些,也随之诞生了各类方法。
这三个参数是目前非常主流用于评估自相互作用的参数,下表总结了三个参数的定义和应用场景。
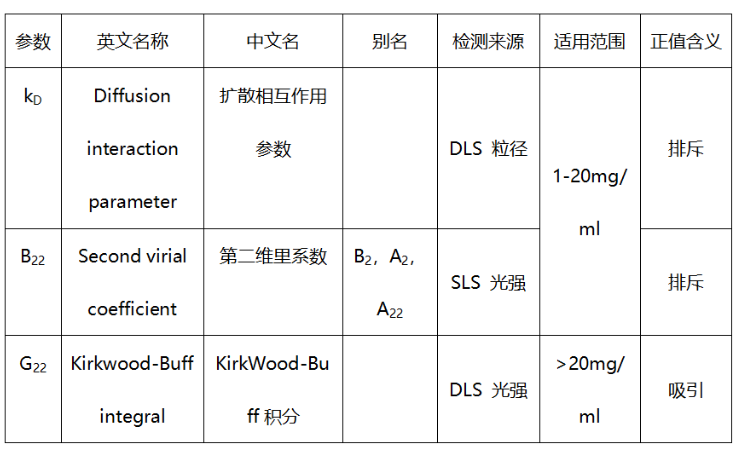

温故而知新, 之前培训时 没特别在意 b22和kd的差别,反正不管怎么样,让它刚“正”不阿就是最好的。但有时两者不一定同时为正值或负值,所以需要根据应用目的不同,应该对症解决。

通过观察扩散系数随浓度增加,如果蛋白质的相互作用随着浓度的增加而增加(相互吸引),那么蛋白质的行为就好像它们变大了,扩散系数也降低了(负斜率)。如果蛋白质的相互作用随着浓度的增加而减少(相互排斥),那么蛋白质的行为就好像它们变小了,扩散系数也增加了(正斜率)。
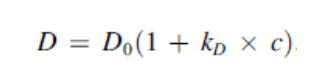
b22与kd相似,但排除了一些蛋白质溶剂效应,沉淀效应以及热力学现象,盐、ph、温度的改变会影响到这些相互作用,有下图公式可知,是由蛋白表观分子量影响。
b22的快速方法是通过观察kc/r90来测量,这就像是观察1/r90。b22测量1/r90如何随着浓度的增加而变化。如果蛋白质的相互作用随着浓度的增加而增加(相互吸引),那么蛋白质的行为就好像它们更大,1/r90减少(负斜率)。如果蛋白质的相互作用随着浓度的增加而减少(相互排斥),那么蛋白质的行为就好像它们变小了,1/r90增加了(正斜率)
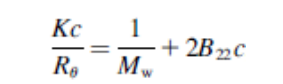
本人看到公式也比较晕,目前工作更偏应用,所以可能来点实战的。

早期可开发性评估和制剂工艺开发侧重点不同,但蛋白必须在一定的处方下才能评价,处方又对数值有影响,所以需要甄别考虑。
也许你只能测kd,正好今天看到一篇2011年的文献,有个公式换算,其是根据得到的8个抗体在含盐和不含盐的条件下做出的拟合曲线。最后得到的方程式
kd=1.06 a2*m-8.9。(a2即b22) 根据这个公式也有学者认为,kd=-8.9以下即可认为b22为负值,该蛋白自己即存在自吸引。
这个还没验证过,各位读者可再验证,期待分享后续结果。

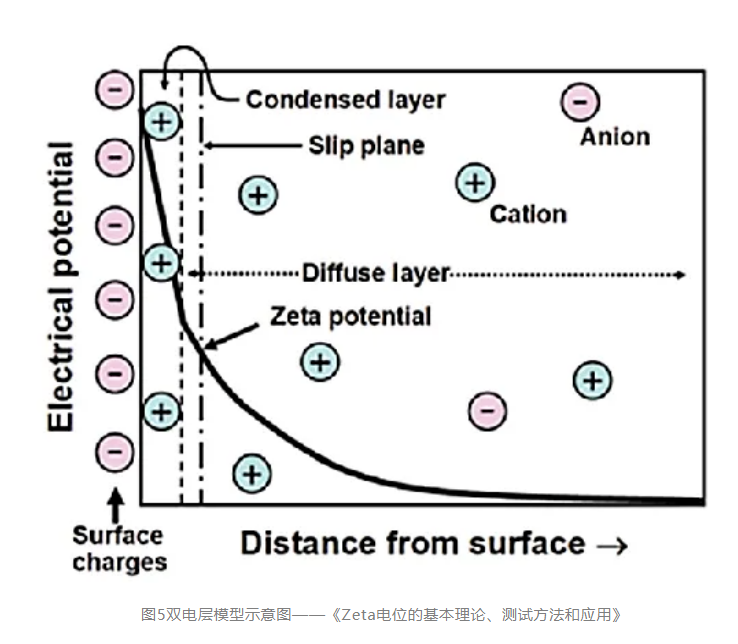
(一)原理:如图5所示,最左侧的“surface charges”可看成分散在水中的固体粒子的表面电荷。悬浮在水中的粒子,其表面的带电基团总是倾向于吸引溶液中带相反电荷的离子(即"反离子")。但所有的离子都具有热能,所以它们会不停地运动。所以离子一方面在静电作用下被吸引到粒子表面,另一方面在热扩散的作用下远离粒子表面,这两种作用的净效果是所有离子在颗粒表面获得某种平衡分布,这种平衡分布也就是形成了离子云。
值得注意的是,图中有一层反离子被画成与粒子表面直接接触,即它们处于所谓的紧密层(condensed layer)中,而另外的反离子被画成是扩散的,即处于所谓的扩散层(diffuse layer)中。紧密层和扩散层相接的地方存在一个滑移层(处于距离紧密层朝外方向很短的地方),大致地我们可以这样认为:粒子在水中运动的时候,滑移层左侧的离子都能跟随粒子一起运动,而其右侧的粒子则没有那么"死心塌地"地跟它走,所以两者之间会产生滑动。在此处,zeta电位指的就是水相中固体粒子的滑动面相对于远处(即离子平衡处)的电位(electrical potential),这个电位通过仪器是可以实际测到的。
(二)数据解读:zeta电位仪检测得到的是正值,就说明蛋白整体表现出来的是正电荷;反之则带负电。zeta电位是对颗粒之间相互排斥或吸引力的强度的度量。分子或分散粒子越小,zeta电位的绝对值(正或负)越高,体系越稳定,即溶解或分散可以抵抗聚集。反之,zeta电位(正或负)越低,越倾向于凝结或凝聚,即吸引力超过了排斥力,分散被破坏而发生凝结或凝聚。因而对于常规条件下,我们会使抗体带正电荷,因而zeta电位数值越大,会有更大的静电排斥,从而降低聚集率。
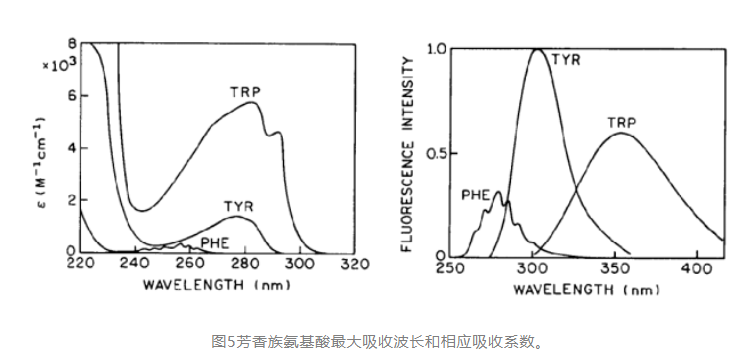
蛋白内主要有三种芳香族氨基酸,苯丙氨酸,酪氨酸,色氨酸。芳香族氨基酸为疏水氨基酸,天然状态下大多是包裹在蛋白内部,仅少量暴露于外部,当蛋白变性后会暴露在极性溶液中,这也是dsf方法测定tm的原理。
色氨酸的对于蛋白荧光的影响最大,通过荧光光谱检测,若出现红移(最大纳米数增加)表示色氨酸更易于分布在表面,易导致色氨酸介导的疏水作用力导致的蛋白相互作用。
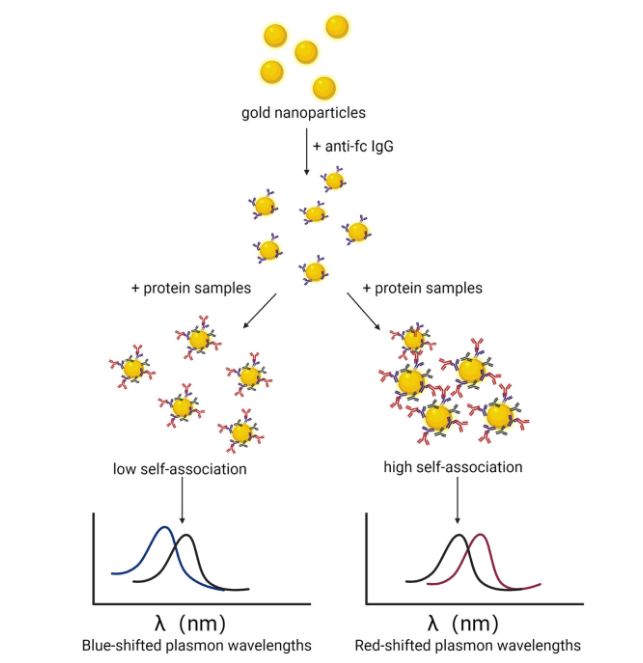
图7 ac-sins不同自相互作用的检测示意图
原理:通过金纳米颗粒包被抗人fc的抗体后,加入待检测含人fc的待测抗体后,与抗fc抗体结合,若待测蛋白fab区域发生自聚合则会拉进纳米颗粒的距离,产生最大吸收波长红移,反之则产生蓝移。通过检测最大吸收波长,来确定待测抗体自身自相互作用情况。
请注意,上述提到,此方法测定的主要是有fab区域介导的自相互作用,非fc区域。但根据文献报道,fab区域也是各抗体间不同的部分,也是主要自相互作用的主要来源,因而该方法测定的值可以客观反应整个分子的情况。
除了上述提到的方法,还有如下方法可用:
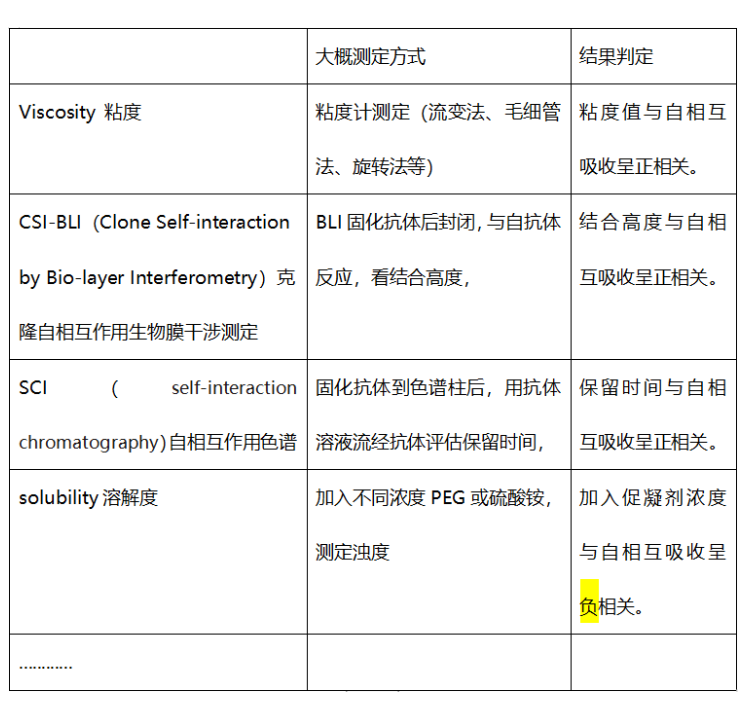
如上所示,存在着很多方法,通过不同原理去评价抗体自相互作用,每个方法所需仪器设备、试剂不同,决定了检测成本和通量,另一方面,这些方法的预测性是否准确,是另一个更重要的考量维度。2021年恒瑞医药发表了一遍文章,以7个单抗及三个抗体复方为样品,比较了四个方法的情况。
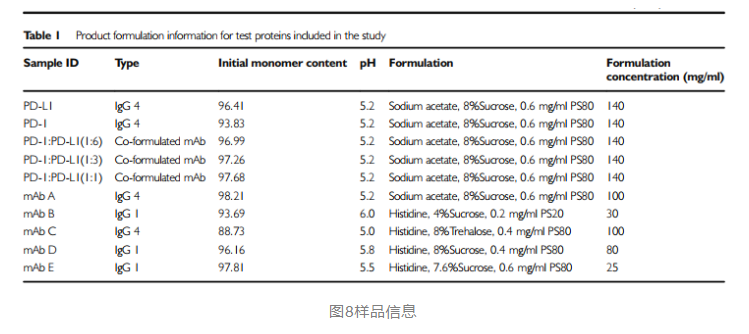
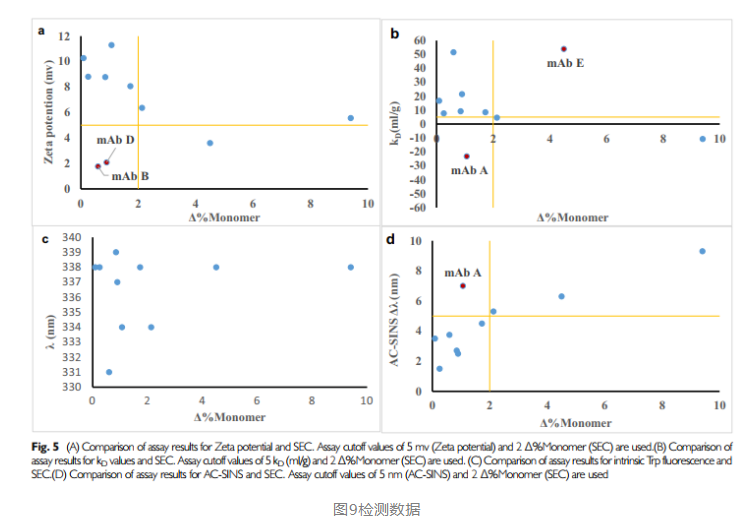
从上述结果可知,荧光色谱与sec结果没有相关性,zeta电势有一定的相关性,但也有两个样品特例,kd和ac-sins均展现了,较好的相关性。(文中用单体量monomer作为横坐标,若是改成hmw,则kd象限中mabe也是符合预期的)。
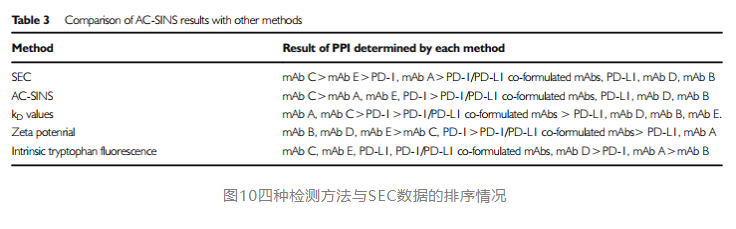
文献作者又分别对四种方法的预测值和最终实验所得的sec-monomer变化率结果进行排序对比,可看到ac-sins的预测排序是与sec排序结果最接近的。(up主觉得,用monomer做排序并不是非常合理,自相互作用主要影响聚集情况,所以用hmw或许更好)。
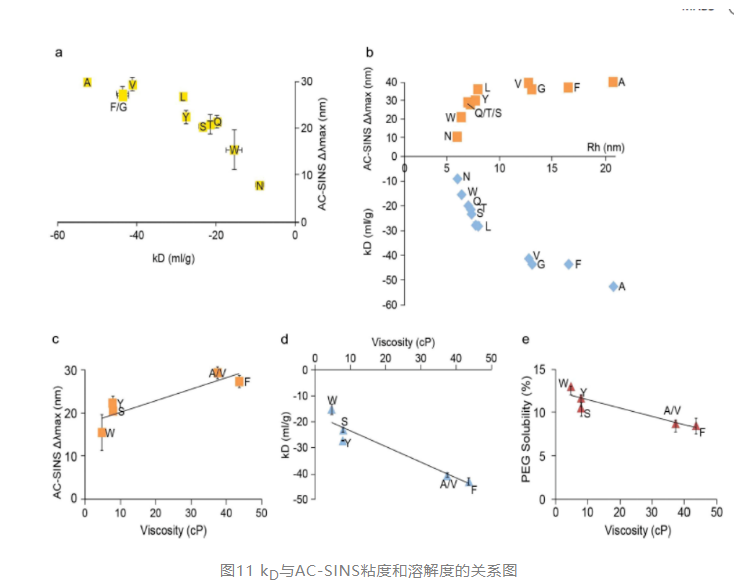
在其他文献中其实也报道了各方法的相关性,如下图所示,ac-sins、kd、粘度、溶解度之间其实都有比较好的相关性。
(一)那么哪种方法最合适?
这没有标准答案,根据各实验室的仪器配置情况、通量、检测目的等来决定(具体方法参数可参考文献,篇幅有限不做详细介绍,后续可再开篇介绍),个人看到的是ac-sins和kd比较多,可做参考。
(二)方法阈值——低于哪个值就认为样品自相互作用很大?
(1)如何判断自吸引或排斥已在前文描述,而对于阈值,各个文献有不同的标准,比如针对ac-sins,有文献以5,有文献以10,也有看到以11.8。原因是每个实验室的实验过程或多或少有差异,会直接导致方法的灵敏度,up主有开发过ac-sins,改变某个值,同一个样品检测数值均会有差异,所以没有一个固定值。
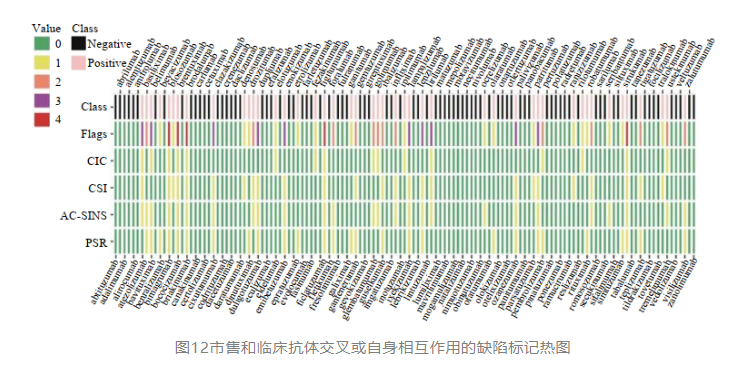
(2)超过阈值就一定不可行吗?其实也不绝对,只是会增加工艺开发和稳定性风险,有多篇文献报道目前市售和临床期间的一些抗体,也有将近1/3有一些交叉或自相互作用的风险问题(如大家熟悉的t药-atezolizumab,其cic、csi、ac-sins都不太好)。所以这个维度只是排序,在保证有效(功能活性)的基础上,尽可能挑选自吸引低的分子,进一步保证安全和稳定。
方法篇介绍完毕,知识有限,必定有遗漏或理解偏颇,请留言或加v沟通交流,在交流中成长,这是写文章和创公众号的初衷之一。
参考文献:
1、uncle培训手册
2、penta培训手册
3、application of affinity-capture self-interaction nanoparticle spectroscopy in predicting protein stability, especially for co-formulated antibodies
4、assessment of net charge and protein–protein interactions of different monoclonal antibodies
5、基于抗体序列的可开发性相关理化性质风险预测
6、zeta电位的基本理论、测试方法和应用
7、predicting antibody developability profiles through early stage discovery screening