药品的质量就是患者的生命和健康,也是制药企业的生命。近日,多家印度头部药企出现了质量问题,值得我们警示。
2022年12月8日,sun pharma收到fda对印度工厂的进口警告,股价下跌,是自2021年5月28日以来最糟糕的一天。去年四季度,太阳制药在美国市场召回超11 万瓶治疗ed的仿制药——他达拉非。美国fda当时解释 ii级召回的原因时说:“生产药品时使用了不正确品级的药用辅料交联聚维酮。”
本周四,太阳制药表示,该公司古吉拉特邦工厂的药品可能会被拒绝进入关键的美国市场,此前fda对该工厂发出进口警告。fda的进口警报意味着,在古吉拉特邦halol工厂生产的所有产品未来都可能被拒绝进入美国市场,直到该工厂符合监管机构的现行良好生产规范标准。

太阳制药表示:“公司将继续与美国fda合作,并将采取一切必要措施来解决这些问题,并确保监管机构对公司的补救行动完全满意。”
太阳制药的股价下跌3.6%,是自2021年5月28日以来最糟糕的一天,在sensex指数上涨160点的当天,太阳制药成为跌幅最大的成分股。该公司在收盘后的另一份文件中表示,对于fda的行动,该公司暂时不会修改本财年的收入预测。
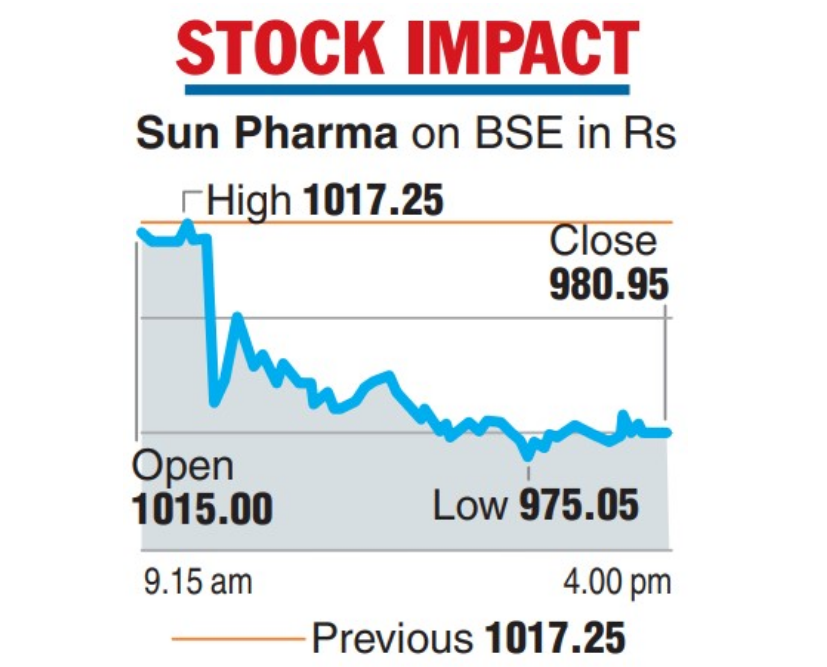
fda已将14种产品排除在进口警报之外,但须符合条件,sun pharma表示这些产品是保密的。目前尚不清楚fda要求该公司采取何种补救措施。太阳制药没有立即回应媒体的进一步置评请求。该公司还表示,正在评估是否会产生任何额外的补救费用。
“进口警报很难消除,一些公司在7-10年后仍然无法使其设施恢复合规,”亚洲市场证券的shrikant akolkar表示。该公司下调了sun pharma的收入和盈利前景,并将目标价下调4.5%至1,156卢比。
太阳制药表示,将harol生产的产品转移到其他地点将是一个复杂而耗时的过程,因此产品转移将根据具体情况进行评估。
2022 年12 月8 日,仿制药制造商aurobindo pharma收到了fda的另外483份检查报告,这次涉及质量问题,特别是对客户投诉的回应。这份长达17页的报告详细介绍了fda对aurobindo位于印度哈斯诺拉的活性药物成分(api)制造工厂进行的检查,美国监管机构共注意到10项观察结果。

首先注意到的是现场质量部门针对市场投诉和“不合格结果”等事项的调查,这些调查在确定根本原因方面并不总是“科学合理”或全面的。该报告还发现,分析测试方法和“清洁分析方法”没有得到适当的验证,并指出现场未能确保所有测试程序在科学上是合理的,并且无法确保原材料和“api中间体”符合既定的质量标准。
该报告还发现,清洁和维护设备的书面程序存在缺陷,实验室控制机制“不充分”,质量控制部门的程序未以书面形式或未完全遵循。发现“起始物料”,原材料和api中间体的储存与指示的位置不同。媒体联系了aurobindo,以了解有关检查的更多详细信息以及该公司正在采取哪些措施来解决报告中的问题,但截至发稿时尚未得到回复。
这不是aurobindo第一次收到美国监管机构的检查报告。今年早些时候,aurobindo在检查该公司位于印度海得拉巴市外jadcherla的口腔制造工厂后收到了483表格。该报告显示了几项质量控制观察结果,但该公司已承诺与fda合作解决问题。
10月,该公司的美国分公司aurobindo pharma usa也发布了两批心脏药物喹那普利的自愿召回。此次召回是针对高于拟议限值的“亚硝胺原料药相关杂质”发出的。如果人们长时间接触亚硝胺,会增加患癌症的风险。
今年春季,aurobindo还关闭了新泽西州的一家制造工厂。
2022年12月6,有媒体报道,印度仿制药生产商glenmark pharmaceuticals已收到美国监管机构的警告信。这封信于11月22日寄给制造商,指出了夏季在印度果阿邦科尔维尔镇的格伦马克工厂进行检查中发现的问题。

根据这封信,fda发现glenmark对被拒绝批次的药物的调查“未能扩展到其他批次,剂量强度和药品”。警告信还指出,该站点未能为生产和过程控制建立“适当的书面程序”,以确保药物具有正确的强度,质量和纯度。
根据fda的说法,glenmark还缺乏审查“色谱数据处理”的“适当程序”,并且被发现批次记录不完整,遗漏了特定批次的数据。
信中说:有两项调查发现不合格的片剂不符合硬度规格。在每项调查中,影响评估得出的结论是,由于打开了自动重量控制或压实力控制,因此发现不符合规格的片剂的风险很低。但是,调查没有确定拒绝限制是否适当。缺乏保证来确保压缩机正确剔除不符合规格的药片。
glenmark有15天的时间回复这封信。endpoint news联系了glenmark寻求进一步评论,但截至发稿时尚未收到回复。
glenmark并不是印度果阿邦唯一受到警告信的制造商。印度仿制药企cipla在夏天收到了一封信,原因是印度的一家工厂缺乏清洁。cipla工厂在9月份也收到了qc问题和清洁度的483报告。
参考资料:https://endpts.com/