目前,发现了一种简单有效的“一锅法”来合成环胺,它是用socl2使胺醇氯化来实现的。它与以前的经典反应过程不同,转化过程中不需要经历n的保护/o的活化/环化/脱保护一系列过程。
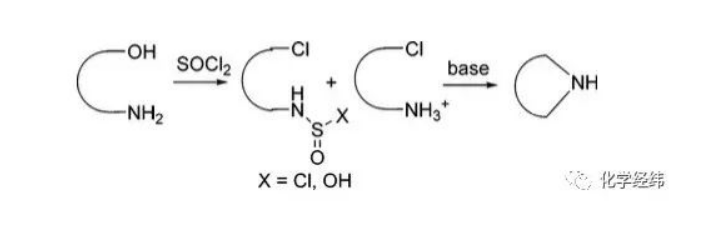
合成含n杂环化合物的一个非常重要的方法就是运用胺醇的环化脱水反应。尽管人们发现了很多环化脱水的方法,只可惜经典的环化脱水反应步骤十分繁琐,从而大大降低了转化的效率。通常所用的环胺直接进行胺醇的环化脱水反应,包括以下几种:
1. 具有氧化还原作用的有机金属试剂,如ruh2(pph3)4 和ruh(pph3)4,
2. 酸性条件下与适合的底物生成相应的阳离子中间体,
3. 有p参与的mitsunobu反应,
4.包含卤化在内的直接活化来形成卤胺的中间体。例如:应用比较广泛的是appel反应以及它的变体,尽管它在大规模合成中还存在很多缺陷。
然而,虽然几十年前人们就发现了用socl2,自由碱使胺醇直接氯化,但是一直以来没有得到很好的研究。其原因是n与o之间的亚硫磺酰化反应的竞争和一系列不可避免的副反应,另外收率较低也是比较有代表性的原因之一。

最近,在不对称合成化合物1a和1b的过程中,发现了一种很实用的方法,用socl2使胺醇直接氯化来合成化合物3,随后迅速环合成化合物1,这一过程通过水溶液中ph值的调节来监测,并且得到了几乎定量的收率。
另外,还发现在用socl2使醇氯化的过程中形成了氯磺酰酯中间体。已经有人将其分离出来。同时还发现在碱性条件下用socl2处理1,2-胺醇得到的磺酰胺是最初形成的氯磺酰酯或者胺的分子内o或n的磺酰化产物。通过一些相关文献的查阅发现这类反应典型的做法是将socl2在碱性或非碱性的环境中加入底物的溶液中。反应的收率很低。事实上,当把socl2,慢慢加入到含有自由碱的2的i-proac或(meoch2)2溶液中时,3的收率仍然比较低。当0.3当量socl2加入时,溶液变为黑红色,并且有粘稠的固体生成。hplc的分析结果表明生成了很多副产物。
然而,假如亲核胺在酸性条件下可以通过快速的质子化和n的亚磺酰化来进行保护和脱保护,那么用socl2实现这一环化脱水转化应该是可以做到的。通过亲核胺进攻n或o磺酰化形成的磺酰胺副产物的种类也会大大减少。
为了证实这一假设,将socl2的i-proac溶液加入到2b的盐酸盐中。由于亲核胺被保护起来,副产物出乎意料的少。但是由于相应的胺的盐酸盐的溶解性很差,会从溶液中析出来,从而说明氯化反应是不完全的。有趣的是,如果将加料顺序颠倒,就得到了一个很好的均相反应。在这种反加的情况下,hplc的分析表明2b完全转化为相应的氯化物3b。
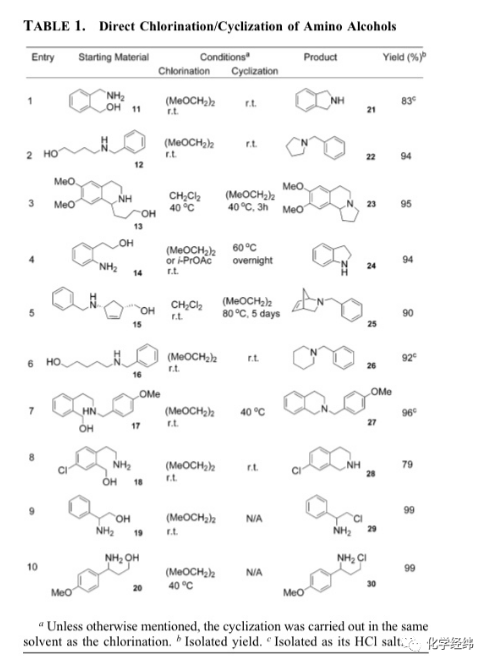
为了更进一步的研究氯化/环合脱水的步骤,还对不同种类的胺进行了研究,研究的结果在table1中作了总结。在一系列的实验中,将胺醇化合物的i-proac,(meoch2)2或ch2cl2溶液慢慢的加入到socl2的该种溶液中。我们惊奇的发现所有的胺醇化合物都以很高的转化率几乎定量的转化为相应的氯化物。
总之,我们对传统的胺醇的氯化/环化脱水反应进行了优化,活化了oh基,发现了一种简单的在socl2的条件下胺醇的氯化方法。进一步推广到用“一锅法” 来进行胺醇的环化脱水反应。