13年参加工作,开始从事药学质量基础研究工作。18年因为工作晋升需要,专门去学习了项目管理,并取得了项目管理专业人士资格认证(pmp)。起初将相关理论应用在多个仿制药和创新药的项目管理上,主要包括协调整合部门有限资源,控制研发成本,快速推进各项目申报进度等。后来,将“凡事皆项目”扩展到了平时的基础研究工作中,发现项目管理的核心理论“戴明环pdca”可以有效提高工作效率,是个非常好用的工具。
基于此,本文先简要介绍一下项目管理相关的基本理论知识,再以实例的方式介绍项目管理理论在药物稳定性研究过程中的应用。
了解之后,可以举一反三,应用于工作中任何一项任务。
1、基本概念
1.1、项目
项目是为创造独特的产品、服务或成果而进行的临时性工作。
项目具有临时性和独特性两个特点。
临时性是指由明确的起点和终点,并不意味着持续时间短,很多项目的结果或影响具有持久性。
独特性是指项目创造独特的可交付成果,因此也导致了不确定性和风险,这就需要比常规例行工作做更多的精心规划。
项目有三重制约因素包括范围、时间和成本(简称范时成)。
1.2 项目管理
项目管理是指在项目活动中运用专门的知识、技能、工具和方法,使项目能够在有限资源限定条件下,实现或超过设定的需求和期望的过程。
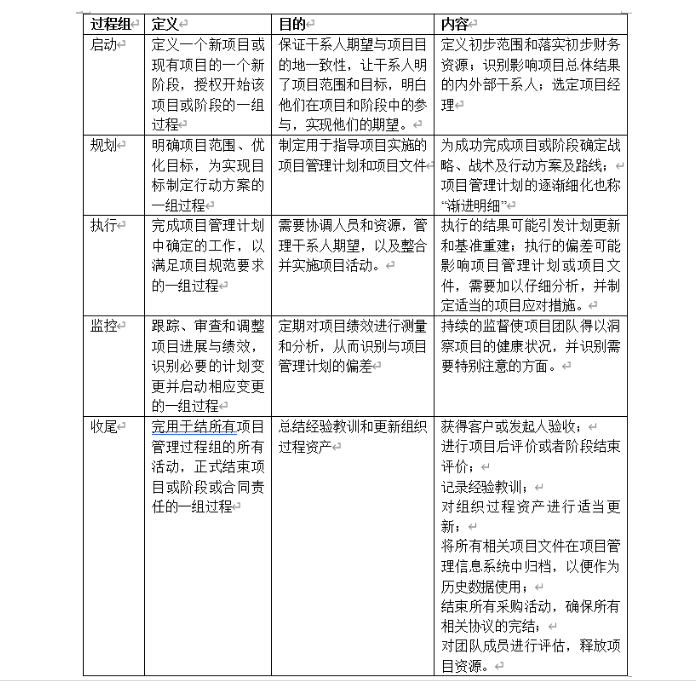
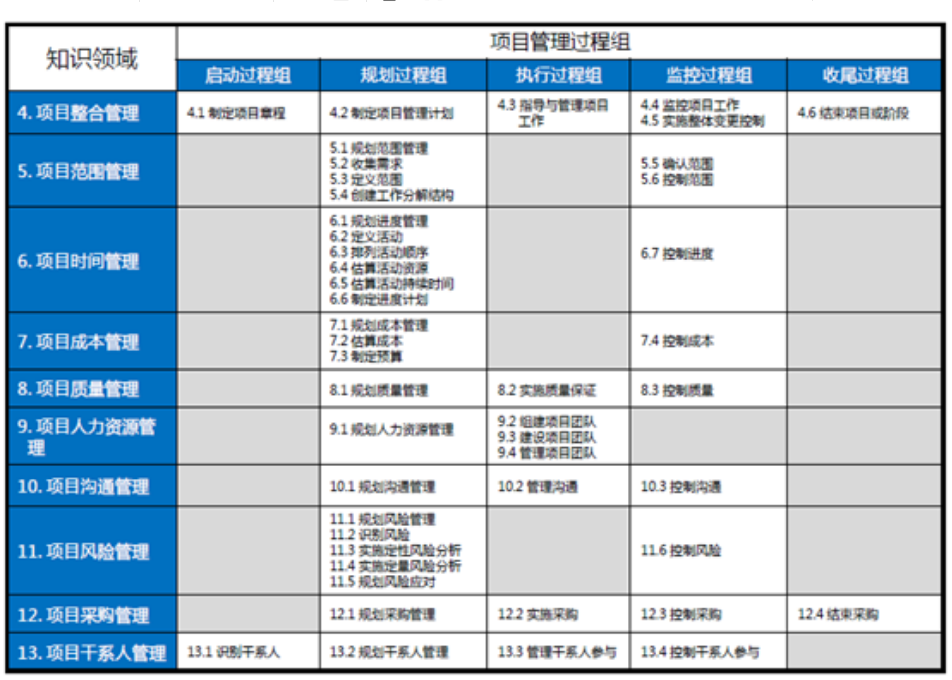
项目管理通过合理运用和整合47个项目管理过程得以实现。
这47个项目管理过程归类于五大过程组:
p-plan计划;这五个过程组的核心管理理论就是戴明环pdca:
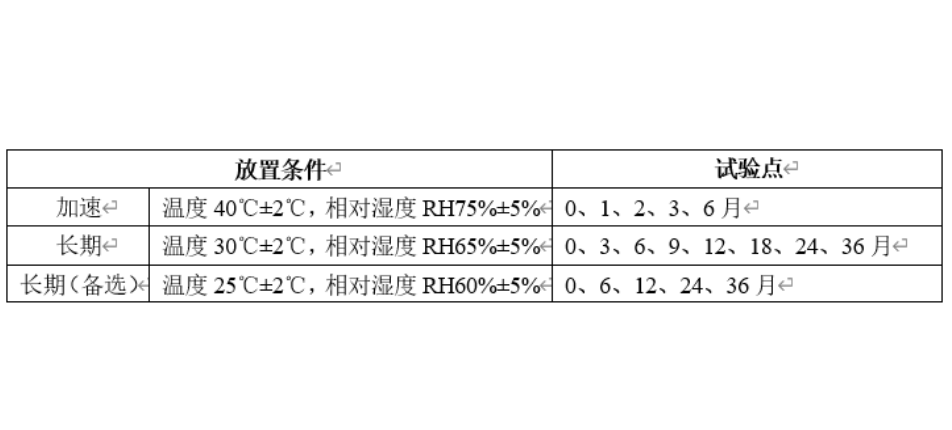
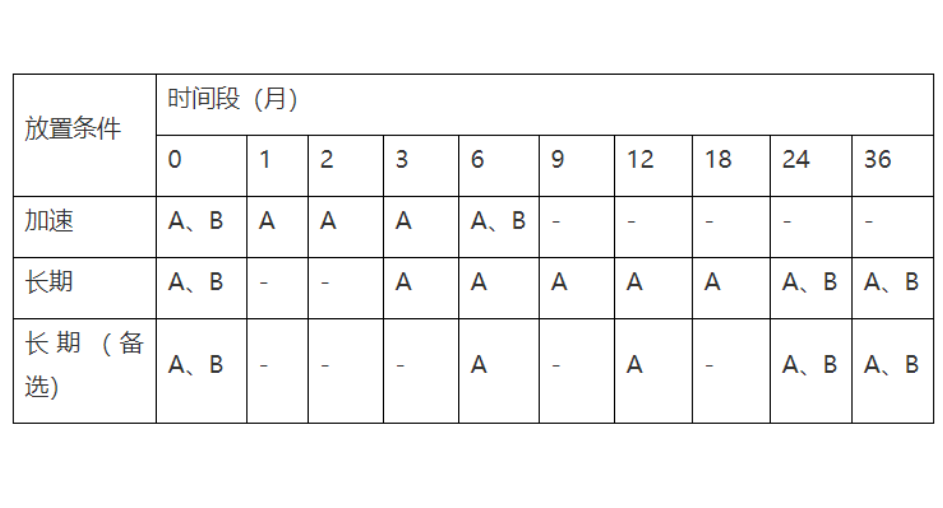
将上述五个过程应用于项目中的10个不同知识领域,这就是形成了项目管理的核心知识体系(见下表):药物稳定性研究是考察原料药或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药安全有效。《中国药典》2020版四部通则9001原料药物与制剂稳定性试验指导原则,分别对原料药物和药物制剂的稳定性试验提出了具体要求,包括试验类型、样品批次选择、放置条件、考察时间点、考察关键项目指标、检验方法专属性与准确性等。原料药物与制剂稳定性试验的启动时间根据项目申报阶段和研究进度而定,以计划申报临床试验的项目为例,原料和制剂均可以在小试验证结束后启动影响试验,在中试放大之后启动加速试验(中间条件试验)和长期试验。规划范围的前提是充分了解事业环境因素,也就是要解读相关法规和指导原则,科学合理的设计研究方案。影响因素:1批/规格;裸置;温度(40℃/60℃)、湿度(rh75%/rh92.5%)和光照;5天、10天和30天;考察指标(比如某片剂,外观、增失重、溶出度、有关物质和含量等);加速试验:3批/规格;市售包装;根据样品性质选择加速考察条件(比如温度40℃±2℃,相对湿度rh75%±5%);1、2、3和6月;考察指标(比如某胶囊,外观、增失重、溶出度、水分、有关物质和含量等);长期试验:3批/规格;市售包装;根据样品性质选择长期考察条件(比如温度30℃±2℃,相对湿度rh65%±5%);3、6、9、12、18、24和36月;考察指标(比如某颗粒剂,外观、增失重、溶出度、粒度、有关物质和含量等)。规划时间主要基于稳定性研究考察条件的设计、考察时间点的设计、关键考察指标的设计、考察样品批次、实验室检验人员仪器等资源情况,以及检验时效性要求等。比如,影响因素考察一批原料药;设计高温40℃/60℃,高湿rh75%/rh92.5%和光照(5000lux)五个条件;考察时间点设计为5天、10天和30天,每个时间点待测样品5个;每个时间点考察外观、增失重、熔点、晶型、有关物质、潜在致突变杂质和含量等;检验人员(是否熟悉项目,是否经过相关培训);对照品或试剂资源是否具备;仪器(ph计、天平、hplc等)状态;各分析方法也进行了初步的验证研究;检验记录模板有效等。规划成本一般会基于稳定性试验方案,以每个点样品批次、考察条件、考察项目、检验人员和仪器试剂等资源需求,再乘以相应点数即可。稳定性试验点时间表产品拟国内上市,我国总体属于亚热带(ⅱ),部分地区属于湿热带(ⅳ a),长期试验采用30℃/65%rh,25℃/60%rh作为长期备选研究(或与之前稳定性研究数据的对比研究)。注:“长期(备选)”试验点放样,若“长期”数据无异常可不进行检测;
异常情况包括:长期数据检查项超出标准或出现oot(与之前稳定性研究批次数据)。注:a考察项目:外观,有关物质、潜在致突变杂质、溶出度、含量、粒度;本品存在规格等设计因子,因临床使用方案的不确定性,暂不采用括号设计法或矩阵设计法进行简化设计。2x为长期(备选)试验点放样,若“长期”数据无异常可不进行检测,异常情况包括:长期数据检查项超出标准或出现oot(与之前稳定性研究批次数据)。到取样时间点,按要求取样并在有效时间内进行检验,撰写记录,整理图谱,绘制趋势线等,对应执行过程中的所有登记信息,要按照实验室sop或法规要求进行填写。对每个时间点的检验数据进行横向分析(与预实验比较,或与其他批次数据进行比较等),判断数据的有效性和准确性,如为异常数据(oot或oos),及时进行偏差调查。对监控过程中发现的问题,及时采取补救,比如,稳定性期间发现的有关物质分析方法专属性不能满足试验要求的,新的降解杂质不能被有效分离的,或发现溶出度标准介质选择不合理,不具有区分力的,应及时优化分析方法。另需要及时监控药物稳定性箱的运行状态,对温度和湿度偏离超出可接受范围的仪器进行及时修理,并对考察样品评估其影响程度。影响因素试验一般考察5天、10天和30天,可以在全部试验结束后,汇总所有的实验数据、图谱和报告,形成该稳定性试验的总结报告。了解原料药或制剂对光照、温度和湿度的敏感程度,选择合适的包装材料。加速(中间)试验一般考察1月、2月、3月和6月,可以在全部试验结束后,汇总整理各个时间点的数据、图谱和报告,形成该稳定性试验的阶段总结报告(一般会同时整理长期条件6个月)。长期试验周期较长,根据原料药或制剂的性质,会持续24个月、36个月,甚至更长时间,所以,对于长期试验的收尾会采用阶段性收尾和全部收尾两种方式。例如,某原料药长期试验考察时间点设计为3、6、9、12、18、24、36和48个月,会连同加速试验在6月阶段收尾一次,其后会在12、24、36月阶段收尾各1次,待48月时间点结束,进行该项目的全部收尾工作。对于某项目某个申报阶段下的稳定性试验正式收尾,一般会将该项目的所有稳定性试验相关的数据、图谱和报告全部整理汇总,分析后评价该原料药或制剂在温度、湿度和光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期(复验期)的确定提供科学依据,以保障临床用药安全有效。当然,药物研发过程中,特别是创新药研究,具有渐进性、阶段性和不确定性特点,在稳定性考察期间可能会涉及到考察方案的变更,甚至终止,总之,在标识项目收尾的时间节点后,总结必要的经验教训,形成必要的组织过程资产(如模板类文件等),不能成为“烂尾房”。以上,项目管理五个过程组在药物稳定性研究中的应用,强调重视规划过程和收尾阶段。