在新冠疫情爆发后,mrna疫苗的高效研发带动了整个核酸药物领域的高速发展,国内外资本瞄准其庞大的市场空间及发展潜力,纷纷布局,核酸药物的研发成为全球最炙手可热的领域之一,作为核酸药物中的代表,小核酸药物展现了极大的潜力。小核酸药物,即寡核苷酸药物,是由十几个到几十个核苷酸串联组成的短链核酸,目前大部分寡核苷酸药物都是采取固相亚磷酸酰胺化学法进行合成,其中,核心物料核苷亚磷酸酰胺单体(核苷单体)的制备是固相合成工艺的关键技术,具有较高的技术壁垒。
1
核苷单体的基本结构
核苷单体是小核酸药物的关键物料,如图1所示,合成dna的亚磷酰胺单体主要由碱基、脱氧核糖、5''-dmt和3''端的2-氰乙基以及二异丙胺基组成,而rna的亚磷酰胺单体中则需要对2''-oh进行保护,以防止在固相合成中2''-oh与5''-oh发生交叉反应,该保护基团一般为tbdms。此外,由于腺嘌呤、胞嘧啶和鸟嘌呤和一些人工碱基存在伯氨基,因此也需要在单元中用适当的保护基团对其保护。
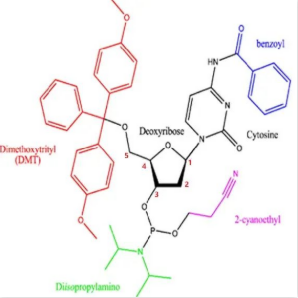
图1:dna的亚磷酰胺单体
2
核苷单体的化学修饰—攻克小核酸药物的成药性瓶颈
由于原始的小核酸结构容易被体内核酸酶降解、药代动力学性质差等原因,一般不能直接作为药物使用,需要经过多位点的化学修饰以提高其亲和力、稳定性、代谢性质等。经过数十年的积累,已经发展了3代技术。常用的化学修饰是第一代的硫代磷酸酯和第二代的甲基膦酸酯。膦酸甲酯不带电,因此比天然dna或rna更具亲脂性,并且可以更好地穿透细胞。后续又产生了第三代pna、lna等技术。
· 第一代技术—磷酸骨架修饰
磷酸骨架修饰是最基本的化学修饰,其中使用较多的骨架修饰为硫代磷酸,即用一个硫原子取代磷酸二酯键的非桥氧原子(p-s替代p-o),可以减少寡核苷酸的亲水性、增加了对核酸酶降解的抵抗力,提高了药物稳定性和半衰期,是第一代小核酸药物中常见的化学修饰。
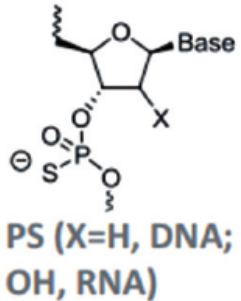
图2:硫代磷酸修饰
· 第二代技术—核糖修饰
主要是对核糖结构部分的羟基进行化学修饰,核糖修饰可影响小核酸和靶标rna的亲和力、对核酶的稳定性以及与rna结合后的性质。由于rna和dna的结构仅差一个2’位的羟基,因此该羟基微小的改变就足以引起显著效应,也决定着rna糖基部分的构像,最终影响与靶rna的亲和力。羟基的修饰还可以改变磷酸部分对核酸酶的敏感性,影响药物的体内稳定性。常用的修饰包括2’-o-甲基修饰,2’-o-甲氧乙基修饰(2’-moe),氟(f)取代等。
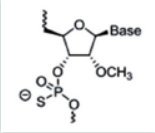
图3:2ʹ-o-甲基修饰
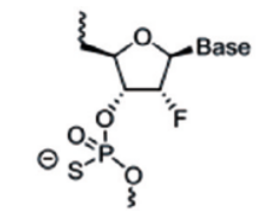
图4:2ʹ-氟取代修饰
· 第三代技术—核糖五元环修饰
主要是对核糖结构部分的母环进行更多的化学修饰,改善成药性。包括lna(锁核酸,locked nucleic acid)、pna(肽核酸,peptide nucleic acid)、pmo(吗啉代寡核苷酸,phosphoroamidate morpholino oligomer)等。lna是经典的核苷酸桥接修饰技术,其通过核苷酸第2和第4个碳原子之间的桥连而将其构象固定,增强了药物对核酸酶的抗性以及对靶mrna的亲和力。pna和pmo改造可以增强核酸药物对核酸酶的抵抗、提高亲和力和特异性等。
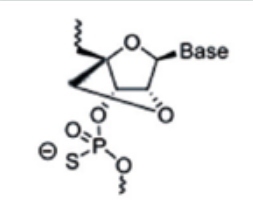
图5:lna修饰
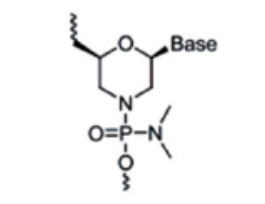
图6:pmo修饰
3
核苷单体的行业壁垒
符合质量要求的核苷单体是小核酸药物商业化的关键因素,核苷单体往往在合成后需要进行化学修饰才能进行后续使用,化学修饰将直接影响小核酸药物的稳定性等各项性能指标。试验阶段的小核酸药物研发无需大规模的单体量产,进入商业化阶段后,生产规模将极大地影响研发进度和商品生产进度及生产成本。

4
核苷单体在小核酸药物中的应用—已上市的小核酸药物
小核酸药物由多个核苷单体串联组成,目前上市在售的小核酸药物有12款,各药物核苷单体组成数量如下表所示。小核酸药物全球市场规模从2016年0.1亿美元已增长至2021年32.5亿美元,年复合增长率高达217.8%。小核酸药物市场规模的持续增长,将带动了核苷单体整体产业规模的增长。
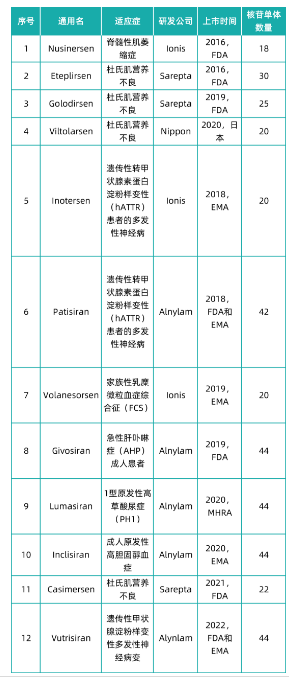
· nusinersen
nusinersen (诺西那生)由ionis和biogen联合开发,是治疗脊髓性肌萎缩症儿童和成人的首个药物,于2016 年12 月23日获得美国fda 批准上市,2017 年6 月1 日获得欧洲ema 批准,2019年2月在中国上市,商品名为spinraza。nusinersen 自上市也来,销售连年爆炸式增长,已经成为突破20 亿美金以上的重磅炸弹级药物。nusinersen 含18 个核苷酸,结构被修饰为gapmer 型,两端为2’-moe,所有胞嘧啶碱基的5’引入了甲基,以消减免疫刺激副作用。
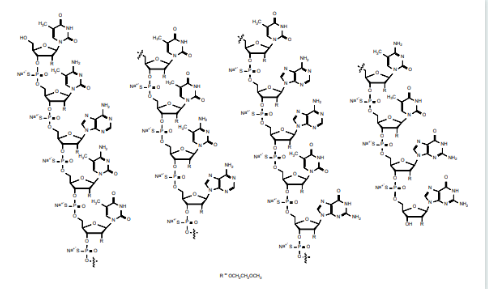
图7:nusinersen结构
· eteplirsen
eteplisen 由avi biopharma(后改名为sarepta therapeutics)研发,于2016年9 月19 日获得美国fda 加速批准上市,商品名为exondys 51,成为首个获批治疗杜氏肌营养不良症(dmd)的药物,年销售额已超4亿美元。eteplirsen 含有30 个核苷酸,序列为ctccaacatcaaggaagatggcatttct,并且经过pmo 修饰。与常规rna 或dna 相比,pmo 碱基与吗啉部分相连,并且亚基通过磷酸二氨基酯键连接,该键在生理上呈中性电荷ph 值。pmo 的骨架保留了对目标rna 的强结合力,以及序列的特异性,并且不容易被核酸酶降解,但是药物比较长的核苷酸链导致跨膜比ps 骨架更困难,但结合dmd 患者的特点,这种结构反而增强了dmd 患者的选择性。因为dmd 患者的肌细胞有不稳定的细胞膜结构,核酸药物可以通过空隙进入细胞。而正常的细胞很难进去,从而使得pmo 核酸进入杜氏肌细胞的药物量是其他细胞的10 倍以上。
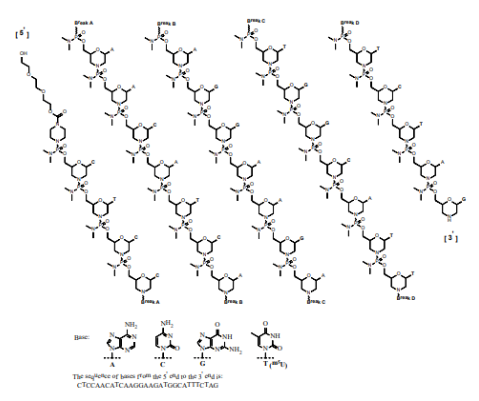
图8:eteplirsen结构
· patisiran
patisiran 由alnylam研发,于2018年8 月获得美国fda及ema批准上市。良好的疗效使得patisiran 获得了商业上的成功,尽管patisiran 定价高昂,年化的费用达到了45万 美金,但其成熟工艺及序列选择、修饰技术带来了确切的疗效,极大的满足了患者的需求,该产品在2018 年q4 上市后就取得了巨大的成功,每季度保持了销售额的高速增长,2021年在全球范围内的业绩达到4.75亿美元,同比增长55%。patisiran 是化学合成的双链寡核苷酸,正义链和反义链各包含21 个核苷酸。正义链的19 个核苷酸与反义链的互补19 个核苷酸杂交,从而形成19 个核苷酸碱基对,并在每条链上留下两个3’-末端核苷酸作为未杂交的突出端,在修饰上patisiran 同时应用了2’-o-m 和2’-o-me 修饰。
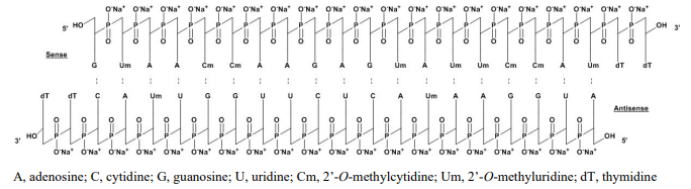
图9:patisiran结构
· givosiran
givosiran 由alnylam 研发,2019 年11 月fda批准上市,成为全球第二款rnai 药物,也是第一个治疗成人急性肝卟啉症(ahp)的药物,也是第一个用galnac 偶联技术上市的sirna 药物,其在巴西、加拿大、瑞士和日本也已获批。该药物在2021年的业绩达到1.28亿美元,同比增长132%,具有极大的市场潜力。givosiran是一种化学合成的双链寡核苷酸,正义链有21个核苷酸,反义链23个核苷酸,并且经过2’-f和2’-o-甲基修饰。givosiran 使用了增强的稳定化学( esc )-galnac-sirna 共轭技术,通过esc 修饰方式增强了双链对核酸酶的稳定性。另外,附着于正义链的3’末端的靶向肝细胞的配体具有3 个galnac,其他三个末端(正义链的5’和反义链的3’,5’)在每侧的最后两个亚基中具有硫代磷酸酯键。这种结合(esc-galnac-sirna)在sirna 皮下给药后具有增强的稳定性,并且与标准模板化学(stc)相比,该药物的效力提高了10 倍。
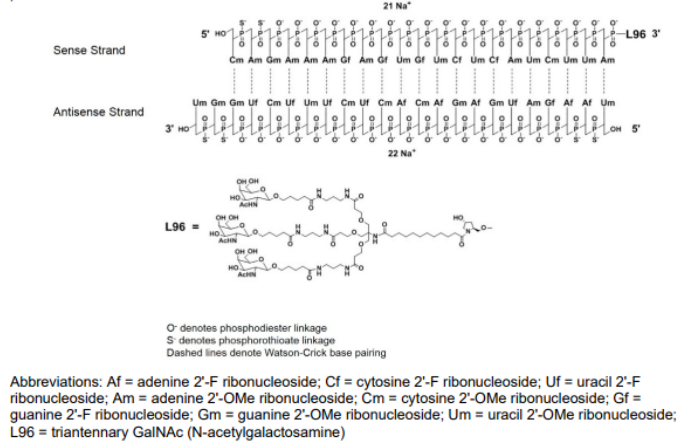
图10:givosiran结构
· inclisiran
inclisiran是降低胆固醇的rnai 疗法,目前用于降低ldl-c (低密度脂蛋白胆固醇)的药物包括汀类药物和抗体类药物,但汀类药物对于严重高胆固醇血症患者及他汀不耐受患者均得不到控制,而抗体类药物面临着极高的成本或频繁给药问题,因此,采用创新的疗法来替代他汀类治疗或抗体联合治疗成为解决这一大众化心血管疾病的迫切需求。inclisiran 由alnylam研发,于2020年获ema批准上市,是首款降低ldl-c 的rnai 疗法, 其上市是rnai 以及小核酸疗法的一个里程碑事件,它预示着这一全新的治疗模式在治疗患者人数众多的慢性疾病中的强大潜力。inclisiran是合成的化学修饰的双链小核酸(sirna),正义链包含21个核苷酸,反义链包含23个核苷酸,化学修饰包括硫代磷酸酯、 2’-f、2’-甲氧基,和三价galnac等。
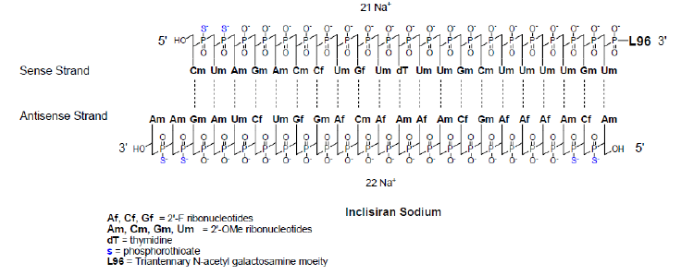
图11:inclisiran结构
5
核苷单体将迎来爆发期—小核酸药物研发热潮
ionis、alnylam、sarepta 是小核酸药物领域的三巨头,目前国内的小核酸药企业都还处于发展初期或者上升期,领先企业包括苏州瑞博生物、苏州圣诺制药、合全药业、中美瑞康等。小核酸药物相比现有的小分子和抗体药物具有靶点筛选快、研发成功率高、不易产生耐药性、更广泛的治疗领域和长效性等优点,具有较大发展潜力,伴随着技术的持续进步,小核酸药物有望形成继小分子药物、抗体之后的现代新药第三次浪潮。据不完全统计,全球目前在研的小核酸药物近500种,从临床在研管线类型来看,全球小核酸药物进入临床管线的共有近100个,6个品种处于临床3期研究阶段。随着小核酸药物研发热潮的到来,核苷单体的需求将迎来爆发期。

· eplontersen
遗传性甲状腺素转运蛋白介导的淀粉样多发性神经病(hattr-pn)是一种罕见的遗传性疾病,全球约 10000 名因hattr导致的多发性神经病患者。eplontersen是一种正在开发的用于attr-cm潜在治疗的研究性反义药物,旨在减少甲状腺素转运蛋白或ttr蛋白的产生,以治疗所有类型的ttr淀粉样变性(attr)。
lonis 公司于2020年9月完成的一项随机、双盲、安慰剂对照研究,评估健康日本参与者单次递增和多剂量的安全性、耐受性、药代动力学和药效学,结果显示eplontersen降低了动物和健康志愿者血液中ttr蛋白的水平。2021年12月,阿斯利康(astrazeneca)与ionis达成战略合作,开发和商业化eplontersen。目前该药物正在进行临床3期试验,包括3项:(1)一项3期全球开放标签随机研究,评估其在遗传性甲状腺素转运蛋白介导的淀粉样多发性神经病患者中的有效性和安全性,预计2023年9月完成;(2)一项开放标签的扩展研究,旨在评估其在遗传性甲状腺素介导的淀粉样多发性神经病患者中的长期安全性,预计2024年7月完成;(3)一项3期全球双盲随机安慰剂对照研究,评估在甲状腺素转运蛋白介导的淀粉样心肌病 (attr cm) 患者中的有效性和安全性,预计2025年11月完成。
· tofersen
肌萎缩侧索硬化症(als)是一种致命的神经退行性疾病,由来自大脑和脊髓的运动神经元的缺失引起。该病导致四肢、躯干、胸部、腹部肌肉逐渐无力并萎缩,从而影响运动、交流、吞咽和呼吸功能,最终致死。als的发病率为1.9/105,患病率为4.5/105,平均发病年龄为55岁。
tofersen是biogen在lonis开发的基础上进行再开发的一种反义寡核苷酸,可介导超氧化物歧化酶 1 (sod1) mrna 的 rnase h 依赖性降解,以减少 sod1 蛋白的合成, 可用于肌萎缩侧索硬化 (als) 。2016年1月,biogen和ionis开始了sod1-als的1/2期安全性试验。多剂量阶段于2019年1月完成,根据 2019 年 5 月美国神经病学学会会议上公布并随后发表的结果,aso 治疗是安全的,并且减少了突变的 sod1 蛋白。2021 年 5 月,开始招募一项针对无症状sod1 突变携带者的 3 期研究,在一项为期28周的研究中, tofersen将突变的脑脊液(csf)sod1降低了29%,而安慰剂增加了16%。血浆nfl(神经丝轻链蛋白)在治疗组中下降了60%,在安慰剂组中增加了20%,治疗组的起始值比安慰剂组高出约15%。2022年7月26日,biogen和ionis宣布fda已接受tofersen的新药申请,授予其优先审查。
· cemdisiran
疫球蛋白a肾病(iga肾病)是一种免疫复合物引发的肾小球肾炎,通常表现为血尿、蛋白尿、进展型肾衰竭等症状。iga肾病在全球中发病率较高,且受到人口老龄化背景下,患者数量持续攀升,2021年全球iga肾病患者数量达到930万人,预计到2025年达到980万人。我国iga肾病患者数量也呈现持续攀升,在2021年达到225万人,预计到2025年达到233万人。
cemdisiran是rnai 治疗药物,针对补体途径的末端补体成分 5 (c5),与 n-乙酰半乳糖胺(galnac) 配体结合,可用于治疗补体介导的疾病。2022年6月9日,alnylam公布了cemdisiran对成人免疫球蛋白a肾病(igan)患者2期临床试验结果,该2期试验是一项随机、双盲、安慰剂对照的多中心研究,旨在评估cemdisiran对成人igan患者的疗效和安全性。主要终点是第 32 周时 24 小时尿蛋白与肌酐比值从基线的百分比变化;次要终点包括蛋白尿的额外测量、血尿的变化、部分临床缓解的患者百分比和不良事件的频率。结果显示研究达到主要终点,24 小时尿蛋白肌酐比平均降低 37%,次要终点的结果达到治疗指标,且无药物相关不良反应事件发生。3期临床试验正在进行受试者招募。
· fitusiran
血友病分为 a 、b 两型。b型血友病是由于缺乏必要的凝血因子ix(fix)而造成的凝血功能障碍,发病率大约为3.5万分之一。a型血友病是凝血因子viii(fviii)缺乏所导致的出血性疾病,约占先天性出血性疾病的85%,发病率大约是b型血友病的4倍。
fitusiran是一款在研小干扰rna(sirna)疗法,由赛诺菲与alnylam公司联合开发,用于血友病a和血友病b成人和青少年患者的预防性治疗,无论患者体内是否产生凝血因子抑制物。fitusiran目前已完成2项3期临床试验。第一项3期临床试验的研究对象是体内未产生凝血因子抑制物的12岁以上重度血友病a或血友病b男性患者;第二项3期临床试验的研究对象是体内产生凝血因子抑制物的12岁以上重度血友病a或血友病b男性患者。2项试验均达到了其主要和次要终点,即与对照组相比,每月一次给药fitusiran(80 mg)预防性治疗显著减少了两种类型血友病患者的出血事件,使年出血率(abr)降低超过89%,并且改善了患者的生活质量。3期临床试验的初步数据表明了fitusiran作为血友病a或血友病b患者新治疗选择的潜力。
核苷单体是小核酸药物的基石,其修饰是攻克小核酸药物成药性的瓶颈,符合质量要求的核苷单体是小核酸药物商业化的关键因素,但由于其复杂的工艺、投入成本高、个性化要求高、生产运输标准严格等,具有较高的行业壁垒,需要长时间的技术积累,国内有资质的企业较少。随着小核酸药物研发热潮的到来,将推动核苷单体行业的发展,同时,随着核苷单体的技术进步,也将进一步加快小核酸药物的研发进度,两者相辅相成。